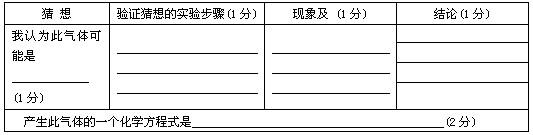
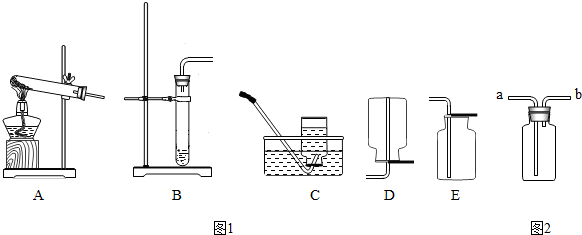
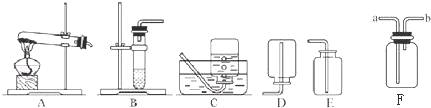
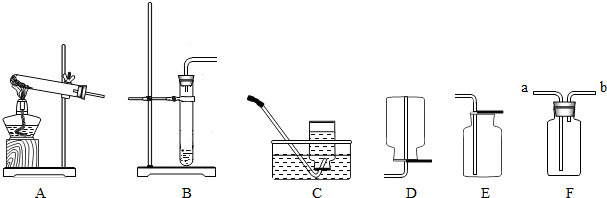
题目内容
老师从实验桌上拿出两瓶常用的但标签已经模糊不清的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体.我们对此气体展开了一系列探究:
(1)猜想:我认为产生的气体能使带火星的木条复燃,我能写出此反应的化学方程式:
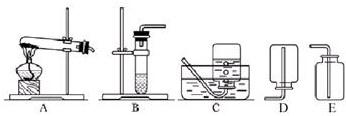
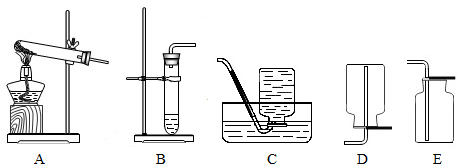
(2)我想制取该气体,发生装置将选取图中的
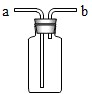
(3)如果用如图中的F装置收集该气体,我认为气体应从
(4)我猜想无色气体还可能是另外一种气体,检验所得气体的方法是
(5)实验室用加热高锰酸钾制取氧气,发生装置应选上图中的
(6)氨气极易溶于水,常温常压下一体积水可溶解700体积的氨气,且氨气的密度比空气小,已知:加热氯化铵和氢氧化钙的固体混合物制取氨气,请从图中选择发生装置

(1)猜想:我认为产生的气体能使带火星的木条复燃,我能写出此反应的化学方程式:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,我知道它的反应类型是
| ||
分解反应
分解反应
.(2)我想制取该气体,发生装置将选取图中的
B
B
(填序号,以下同),收集装置选取C或E
C或E
.(3)如果用如图中的F装置收集该气体,我认为气体应从
a
a
端(填“a”或“b”)导入.(4)我猜想无色气体还可能是另外一种气体,检验所得气体的方法是
将气体通入澄清的石灰水,若澄清的石灰水变浑浊,则证明该气体是二氧化碳
将气体通入澄清的石灰水,若澄清的石灰水变浑浊,则证明该气体是二氧化碳
.化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
收集装置可选取上图中的E
E
〔填序号〕.(5)实验室用加热高锰酸钾制取氧气,发生装置应选上图中的
A
A
装置.实验前还须在试管口塞一团棉花
塞一团棉花
,目的是防止高锰酸钾粉末进入导管
防止高锰酸钾粉末进入导管
.写出该反应的化学反应式2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||
(6)氨气极易溶于水,常温常压下一体积水可溶解700体积的氨气,且氨气的密度比空气小,已知:加热氯化铵和氢氧化钙的固体混合物制取氨气,请从图中选择发生装置
A
A
,收集装置为D
D
.分析:(1)根据产生的气体能使带火星的木条复燃结合化学方程式的书写分析解答;
(2)根据反应物的状态和反应条件确定发生装置,根据所猜想的气体的性质来确定收集装置;
(3)根据气体的密度确定气体的收集方法,而确定气体的进气口;
(4)根据常见气体的实验室制法,结合(1)中的分析,而确定另外的答案;根据所猜想的气体的性质来确定收集装置;
(5)制气装置的选择是依据反应物的状态与条件完成,使用高锰酸钾制氧气时常塞入棉花以净化产生的氧气;
(6)根据反应物的状态和反应条件确定发生装置,根据所猜想的气体的性质来确定收集装置.
(2)根据反应物的状态和反应条件确定发生装置,根据所猜想的气体的性质来确定收集装置;
(3)根据气体的密度确定气体的收集方法,而确定气体的进气口;
(4)根据常见气体的实验室制法,结合(1)中的分析,而确定另外的答案;根据所猜想的气体的性质来确定收集装置;
(5)制气装置的选择是依据反应物的状态与条件完成,使用高锰酸钾制氧气时常塞入棉花以净化产生的氧气;
(6)根据反应物的状态和反应条件确定发生装置,根据所猜想的气体的性质来确定收集装置.
解答:解:(1)产生的气体能使带火星的木条复燃,可知此气体是氧气,反应物是固液,因此是过氧化氢溶液和二氧化锰,反应的化学方程式:2H2O2
2H2O+O2↑;此反应的反应物是一种,生成物是两种,因此反应属于分解反应.
故答案为:2H2O2
2H2O+O2↑;分解反应;
(2)过氧化氢溶液和二氧化锰正确氧气属于固液在常温下反应制取气体,因此发生装置选B;氧气的密度比空气大,不易溶于水,可用向上排空气法和排水法收集.
故答案为:B;C或E;
(3)如果用图中的F装置收集该气体,因为氧气的密度比空气大,气体应从a端导入.
故答案为:a;
(4)固液反应制取气体,这种气体还可能是二氧化碳,检验二氧化碳的方法是将气体通入澄清的石灰水,若澄清的石灰水变浑浊,则证明该气体是二氧化碳;该反应化学方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳的密度比空气,能溶于水,可用向上排空气法收集;
故答案为:将气体通入澄清的石灰水,若澄清的石灰水变浑浊,则证明该气体是二氧化碳;CaCO3+2HCl=CaCl2+H2O+CO2↑;E;
(5)加热高锰酸钾制取氧气,是加热固体,发生装置应选A;高锰酸钾制取氧气时常会带入高锰酸钾的固体颗粒,所以选择使用高锰酸钾制氧气时常塞入棉花以净化产生的氧气;该反应的化学方程式是2KMnO4
K2MnO4+MnO2+O2↑;
故答案为:A;塞一团棉花;防止高锰酸钾粉末进入导管;E;2KMnO4
K2MnO4+MnO2+O2↑;
(6)“加热氯化铵和氢氧化钙的固体混合物制取氨气”属于加热固体制取气体,发生装置应选A;氨气密度小于空气,用向下排空气法收集;极易溶于水,不能用排水法收集.
故答案为:A;D.
| ||
故答案为:2H2O2
| ||
(2)过氧化氢溶液和二氧化锰正确氧气属于固液在常温下反应制取气体,因此发生装置选B;氧气的密度比空气大,不易溶于水,可用向上排空气法和排水法收集.
故答案为:B;C或E;
(3)如果用图中的F装置收集该气体,因为氧气的密度比空气大,气体应从a端导入.
故答案为:a;
(4)固液反应制取气体,这种气体还可能是二氧化碳,检验二氧化碳的方法是将气体通入澄清的石灰水,若澄清的石灰水变浑浊,则证明该气体是二氧化碳;该反应化学方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳的密度比空气,能溶于水,可用向上排空气法收集;
故答案为:将气体通入澄清的石灰水,若澄清的石灰水变浑浊,则证明该气体是二氧化碳;CaCO3+2HCl=CaCl2+H2O+CO2↑;E;
(5)加热高锰酸钾制取氧气,是加热固体,发生装置应选A;高锰酸钾制取氧气时常会带入高锰酸钾的固体颗粒,所以选择使用高锰酸钾制氧气时常塞入棉花以净化产生的氧气;该反应的化学方程式是2KMnO4
| ||
故答案为:A;塞一团棉花;防止高锰酸钾粉末进入导管;E;2KMnO4
| ||
(6)“加热氯化铵和氢氧化钙的固体混合物制取氨气”属于加热固体制取气体,发生装置应选A;氨气密度小于空气,用向下排空气法收集;极易溶于水,不能用排水法收集.
故答案为:A;D.
点评:本题是一道开放性的实验题,考查了学生灵活应用所学知识的能力;对于发生装置的选择要根据药品的状态和反应条件进行选择,收集装置根据气体的性质(密度、溶解性)进行选择.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目