题目内容
【题目】有一包由KCl、MgSO4和CaCl2组成的固体混合物,为了除去其中的MgSO4和CaCl2,得到纯净的KCl,设计如下实验方案:
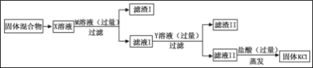
(1)M溶液中的溶质是什么?_____。
(2)请设计实验证明滤液Ⅱ中除KCl外的其他溶质。(写出实验步骤和现象)_____。
(3)最后所得KCl的质量大于原固体中KCl的质量,写出一个可使KCl质量增加的化学方程式。_____。
【答案】Ba(OH)2 取滤液Ⅱ少量,加入足量CaCl2溶液(或BaCl2溶液等),有白色沉淀生成,证明有K2CO3;静置后取上层清液滴加酚酞溶液,溶液变成红色,证明有KOH。 K2CO3+CaCl2=CaCO3↓ +2KCl
【解析】
由KCl、MgSO4和CaCl2组成的固体混合物,加水溶解,然后加过量的氢氧化钡溶液,硫酸镁和氢氧化钡反应生成硫酸钡和氢氧化镁白色沉淀,过滤后,滤液Ⅰ中为氯化钾、氯化钙和氢氧化钡混合溶液,向滤液Ⅰ中加入过量的碳酸钾溶液,氯化钙和碳酸钾反应生成碳酸钙白色沉淀和氯化钾,氢氧化钡和碳酸钾反应生成碳酸钡白色沉淀和氢氧化钾,过滤后,向滤液Ⅱ加盐酸,蒸发即可得到固体氯化钾。
(1)由分析可知,M溶液中的溶质是Ba(OH)2。
(2)滤液Ⅱ为碳酸钾、氢氧化钾、氯化钾的混合物,碳酸钾、氢氧化钾都显碱性,都能使酚酞变红色,所以设计实验证明滤液Ⅱ中除KCl外的其他溶质是:取滤液Ⅱ少量,加入足量CaCl2溶液(或BaCl2溶液等),有白色沉淀生成,证明有K2CO3;静置后取上层清液滴加酚酞溶液,溶液变成红色,证明有KOH;
(3)氢氧化钾、碳酸钾都会与稀盐酸反应生成氯化钾,碳酸钾为后加入的,碳酸钾和氯化钙反应生成碳酸钙沉淀和氯化钾,化学方程式为:K2CO3+CaCl2=CaCO3↓+2KCl。

 阅读快车系列答案
阅读快车系列答案