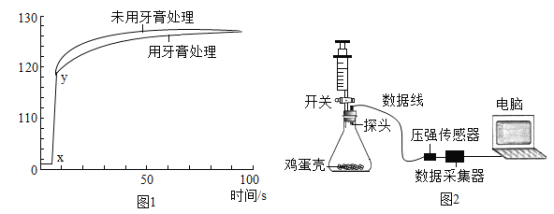
��Ŀ����
����������״�������õ��Ĺ������ᣨC2H4O3����һ�ָ�Ч�����������ɱ����ᣨC2H4O2����˫��ˮ��Ũ������������Ƶã�ʵ��װ�úͲ������£�
����1����������ƿ�м���һ������������Ũ����Ļ����ٻ�����������30%��˫��ˮ������2�����Ͻ��貢����������ƿ�л��Һ���¶�Ϊ20~30������Ӧ����������ƿ���ռ���Ʒ��
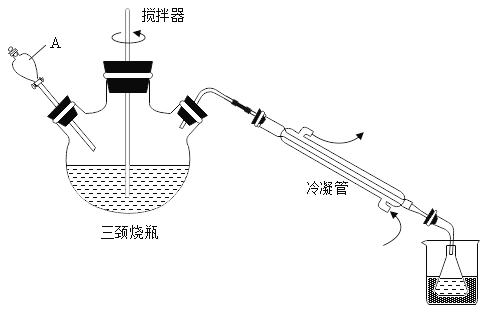
��1������A��������_____
��2������2�����Ŀ����_____
��3�����й��ڹ�������ͱ������˵����ȷ����_____
a��������������������
b�������������Է�������Ϊ76
c����������C��H��OԪ�ص�������Ϊ6��1��8
d��������������Ԫ�ص���������С�ڱ���������Ԫ�ص���������
��4��ʵ���������������������������淴Ӧ����� �ͷ�Ӧʱ��ı仯�������±����ɱ������ݿ�֪����Ӧ����ѱ�����_____����ѷ�Ӧʱ��Լ_____��
�ͷ�Ӧʱ��ı仯�������±����ɱ������ݿ�֪����Ӧ����ѱ�����_____����ѷ�Ӧʱ��Լ_____��
��Ӧ����� | ��Ӧʱ�� | |||||
0.5h | 1h | 3h | 5h | 7h | ||
2��1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% | |
1��1 | 10.56% | 12.92% | 13.54% | 20.72% | 20.80% | |
1��2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% |
��5����Ʒ�й�����������������IJⶨ�������£�ȡ5.00g���������Ʒ����ˮϡ�ͳ�100g��Һ������ȡ��5.00g��Һ���ȳ�ȥ�����H2O2���ټ����Թ�����KI��Һ����ַ�����Ӧ��C2H4O3+2KI+H2SO4=K2SO4+I2+C2H4O2+H2O����Ӧ������ʵ��������I2������Ϊ0.127g���Լ���ԭ��Ʒ�й������������������_____��д��������̣��������1λС������
��6���������ѧ���ġ�һ����������������Һ�����ơ���������0.5%�Ĺ������ᣬ���ڵ��桢ǽ�ڡ��Ŵ���������
��ʵ����Ʒ��������������Ϊ20%�Ĺ������ᣨ�ܶ�Ϊ1.0261g/cm3����ˮ��1000mL��Ͳ��10L����Ͱ��ľ�������֡��۾�����Ƥ���ס�
��ʵ�鲽�裩�ټ��㣺��200mL20%�Ĺ������ᣨ�ܶ�Ϊ1.026g/cm3��ϡ��Ϊ0.5%�Ĺ������ᣬ�����ˮ�����Ϊ_____mL������������һλС������
�����ƣ�����Ͳ��ȡ200mL20%�Ĺ������ᵹ������Ͱ�У���������ˮ����ľ������Ǻ�Ͱ�Ǵ��á�
��ʵ�鷴˼��
�����ڹ��������и�ʴ�ԣ������������ҺʱҪע��_____��
�������ƹ�����������в�����������ԭ����_____��
����ʵ��������ܴﵽʵ��Ŀ���ǣ�������
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | ��ȥCuSO4��Һ�е�H2SO4 | ����������ۣ����� |
B | ��ȥH2��������HCl���� | ���������ͨ��Ũ����������Һ |
C | �������ߺ���ë�� | ��ȼ������ζ |
D | ����NaCl��NH4NO3���� | �ֱ������ˮ�ܽ� |
A.A B.B C.C D.D
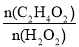


 ��Լ 20%����������Һ����Ҷ����ǩ
��Լ 20%����������Һ����Ҷ����ǩ ̼�������������������
̼������������������� һ����̼��������
һ����̼�������� ������������
������������ ʢ�п������ܱ������е�ȼ����
ʢ�п������ܱ������е�ȼ����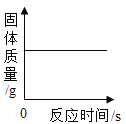 �ö������̺���������Һ������
�ö������̺���������Һ������ ���Ȼ�þ������Ļ����Һ�У����μ�������������Һ
���Ȼ�þ������Ļ����Һ�У����μ�������������Һ �ֱ����������п�ۺ������У���������������������ϡ����
�ֱ����������п�ۺ������У���������������������ϡ����