题目内容
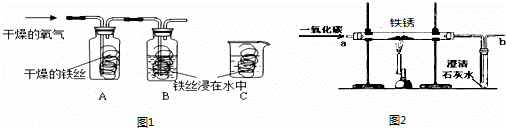
请你结合下列装置图回答问题: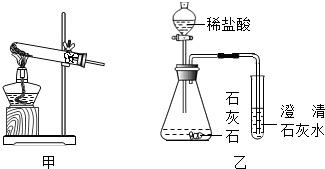
(1)写出有标号仪器的名称:a
(2)实验室用甲装置制氧气的化学方程式是
(3)某化学兴趣小组用乙装置制取并检验二氧化碳.实验过程中,可观察到试管里产生
提出问题:沉淀为什么能溶解变成澄清溶液?
查阅资料:碳酸盐溶于酸,碳酸氢钙[Ca(HCO3)2]溶于水.
猜想与假设:①溶液呈酸性;②反应生成了碳酸氢钙.
实验与结论:
| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:把一小片pH试纸放在一块干净的玻璃片上,用 |
测得被测液的pH=8 | 猜想① (填“成立”或“不成立”) |
| 实验Ⅱ:取沉淀溶解成澄清的溶液于另一支试管中,加入 |
有气体产生 | 反应的化学方程式为: 猜想②成立. |
交流与反思 从探究中你得到的启示或感受是
分析:(1)根据装置图中所指定仪器的图示,写出该仪器的名称;
(2)根据甲装置适用于对固体加热制取氧气的特点,判断利用该装置制取氧气的反应,写出反应的化学方程式,并结合氧气的物理性质,说明收集氧气的方法;默写过氧化氢在二氧化锰催化下分解的化学方程式,并明确反应中二氧化锰的作用;
(3)二氧化碳通入澄清石灰水,石灰水变浑浊,说明沉淀的颜色并默写出访反应的化学方程式;
(4)实验I:测定溶液pH时,通常使用玻璃棒蘸取溶液沾在试纸上;由测定结果及溶液酸碱性与pH数值关系,判断溶液是否如猜想①呈酸性;
实验II:利用碳酸氢钙可与盐酸反应放出气体二氧化碳的性质,结合实验现象,可判断本实验中采取滴加稀盐酸放出气体的方法检验澄清溶液中含有碳酸氢钙.
(5)通过对意外实验现象的进一步探究,可能会获得新的认识.
(2)根据甲装置适用于对固体加热制取氧气的特点,判断利用该装置制取氧气的反应,写出反应的化学方程式,并结合氧气的物理性质,说明收集氧气的方法;默写过氧化氢在二氧化锰催化下分解的化学方程式,并明确反应中二氧化锰的作用;
(3)二氧化碳通入澄清石灰水,石灰水变浑浊,说明沉淀的颜色并默写出访反应的化学方程式;
(4)实验I:测定溶液pH时,通常使用玻璃棒蘸取溶液沾在试纸上;由测定结果及溶液酸碱性与pH数值关系,判断溶液是否如猜想①呈酸性;
实验II:利用碳酸氢钙可与盐酸反应放出气体二氧化碳的性质,结合实验现象,可判断本实验中采取滴加稀盐酸放出气体的方法检验澄清溶液中含有碳酸氢钙.
(5)通过对意外实验现象的进一步探究,可能会获得新的认识.
解答:解:(1)仪器a为装置中用于加热的酒精灯;仪器b为装置中用作反应容器的锥形瓶;
(2)装置甲适用于对固体加热制取气体,因此选用该装置制取氧气的反应为加热分解高锰酸钾,反应的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑;由于氧气密度比空气大且不易溶于水,因此收集氧气时可采取排水法或是向上排空气法进行收集;高锰酸钾分解后加水溶解后过滤所得黑色固体为不溶于水的二氧化锰,二氧化锰能催化过氧化氢分解,反应的化学方程式为2H2O2
2H2O+O2↑;二氧化锰在该反应中起到加热过氧化氢分解的催化作用;
(3)图示的实验中把二氧化碳气体通入澄清石灰水,会观察到澄清石灰水变浑浊,反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O,反应生成碳酸钙白色沉淀;
(4)实验I:为测定澄清溶液的pH,可使用玻璃棒蘸取液体沾在试纸上;根据测定的pH=8,可知该溶液呈碱性,而非猜想①所认为的呈酸性,所以猜想①不成立;
实验II:根据碳酸氢钙能与盐酸反应放出二氧化碳气体,结合实验的现象“有气体产生”,可判断实验操作中加入的为稀盐酸,稀盐酸与碳酸氢钙反应生成氯化钙、水和二氧化碳,化学方程式为Ca(HCO3)2+2HCl═CaCl2+2H2O+2CO2↑;
(5)通过以上探究可发现,实验中的意外现象若正确对待而不是随意忽略,往往会有新的认识与收获.
故答案为:
(1)a、酒精灯;b、锥形瓶;
(2)2KMnO4
K2MnO4+MnO2+O2↑;排水法或向上排空气法;2H2O2
2H2O+O2↑;催化作用;
(3)白;Ca(OH)2+CO2═CaCO3↓+H2O;
(4)实验I:玻璃棒,不成立;实验II:稀盐酸,Ca(HCO3)2+2HCl═CaCl2+2H2O+2CO2↑;
(5)科学地对待实验中的意外现象(合理均可).
(2)装置甲适用于对固体加热制取气体,因此选用该装置制取氧气的反应为加热分解高锰酸钾,反应的化学方程式为2KMnO4
| ||
| ||
(3)图示的实验中把二氧化碳气体通入澄清石灰水,会观察到澄清石灰水变浑浊,反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O,反应生成碳酸钙白色沉淀;
(4)实验I:为测定澄清溶液的pH,可使用玻璃棒蘸取液体沾在试纸上;根据测定的pH=8,可知该溶液呈碱性,而非猜想①所认为的呈酸性,所以猜想①不成立;
实验II:根据碳酸氢钙能与盐酸反应放出二氧化碳气体,结合实验的现象“有气体产生”,可判断实验操作中加入的为稀盐酸,稀盐酸与碳酸氢钙反应生成氯化钙、水和二氧化碳,化学方程式为Ca(HCO3)2+2HCl═CaCl2+2H2O+2CO2↑;
(5)通过以上探究可发现,实验中的意外现象若正确对待而不是随意忽略,往往会有新的认识与收获.
故答案为:
(1)a、酒精灯;b、锥形瓶;
(2)2KMnO4
| ||
| ||
(3)白;Ca(OH)2+CO2═CaCO3↓+H2O;
(4)实验I:玻璃棒,不成立;实验II:稀盐酸,Ca(HCO3)2+2HCl═CaCl2+2H2O+2CO2↑;
(5)科学地对待实验中的意外现象(合理均可).
点评:本题通过对实验室制取气体及性质实验的相关操作与现象的考查,拓展到Ca(HCO3)2的检验,体现运用知识分析问题与解决问题的能力.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
 “嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列航天技术中的化学短文并回答有关问题.
“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列航天技术中的化学短文并回答有关问题.
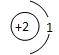 D、原子结构示意图为
D、原子结构示意图为