题目内容
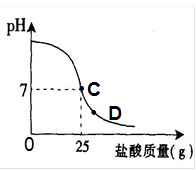
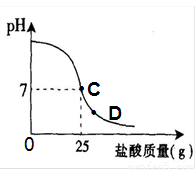
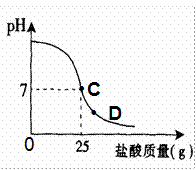
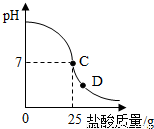
为测定标有质量分数为32%的盐酸的实际质量分数,小明实验时先在烧杯中加入20g40%的氢氧化钠溶液,再逐滴加入该盐酸,测定出加入盐酸的质量与烧杯中溶液pH的关系如图.(1)所用氢氧化钠溶液中溶质的质量为______g.
(2)请认真看清右图信息后回答以下问题
①当滴加盐酸到C点时,所消耗的盐酸中溶质的质量是多少?
②该盐酸的实际质量分数是多少?(保留到0.1%)
③导致盐酸溶液溶质质量分数改变的原因是:______.
④当滴加盐酸到图象中D点时,烧杯中溶液的溶质是______.(填化学式)
【答案】分析:(1)根据溶质质量分数的公式计算;
(2)①观察图示,当滴加盐酸到C点时,溶液的pH=7,25g的盐酸与20g40%的氢氧化钠溶液恰好完全反应,根据盐酸与氢氧化钠的反应,由氢氧化钠的质量求出所消耗的盐酸中溶质的质量;
②根据溶质质量分数的公式计算该盐酸的实际质量分数;
③根据盐酸的挥发性分析;
④根据滴加盐酸到图象中D点时溶液发生的反应以及剩余的反应物分析.
解答:解:(1)所用氢氧化钠溶液中溶质的质量为:20g×40%=8g;
(2)由图示可知,当滴加盐酸到C点时,溶液的pH=7,25g的盐酸与20g40%的氢氧化钠溶液恰好完全反应.
①设25g的盐酸中溶质的质量为x
HCl+NaOH=NaCl+H2O
36.5 40
x 8g
 解得:X=7.3g
解得:X=7.3g
②该盐酸的实际质量分数是: ×100%=29.2%
×100%=29.2%
③盐酸具有挥发性,是导致盐酸溶液溶质质量分数减少的原因;
④由图示可知,当滴加盐酸到图象中D点时,盐酸的量过量,氢氧化钠全部参加反应生成了氯化钠,还有剩余的盐酸,所以,溶液中的溶质是:HCl、NaCl.
故答为:(1)8g;(2)①消耗的盐酸中溶质的质量是7.3克,②该盐酸的实际质量分数是29.2%,③:盐酸有挥发性.④HCl、NaCl.
点评:本题是对溶液及方程式计算题的考查,找到已知量利用化学方程式求出所需的量,进而再利用溶质的质量分数的计算进行求解,完成此题对培养学生分析问题及计算能力有一定帮助.
(2)①观察图示,当滴加盐酸到C点时,溶液的pH=7,25g的盐酸与20g40%的氢氧化钠溶液恰好完全反应,根据盐酸与氢氧化钠的反应,由氢氧化钠的质量求出所消耗的盐酸中溶质的质量;
②根据溶质质量分数的公式计算该盐酸的实际质量分数;
③根据盐酸的挥发性分析;
④根据滴加盐酸到图象中D点时溶液发生的反应以及剩余的反应物分析.
解答:解:(1)所用氢氧化钠溶液中溶质的质量为:20g×40%=8g;
(2)由图示可知,当滴加盐酸到C点时,溶液的pH=7,25g的盐酸与20g40%的氢氧化钠溶液恰好完全反应.
①设25g的盐酸中溶质的质量为x
HCl+NaOH=NaCl+H2O
36.5 40
x 8g
 解得:X=7.3g
解得:X=7.3g②该盐酸的实际质量分数是:
 ×100%=29.2%
×100%=29.2%③盐酸具有挥发性,是导致盐酸溶液溶质质量分数减少的原因;
④由图示可知,当滴加盐酸到图象中D点时,盐酸的量过量,氢氧化钠全部参加反应生成了氯化钠,还有剩余的盐酸,所以,溶液中的溶质是:HCl、NaCl.
故答为:(1)8g;(2)①消耗的盐酸中溶质的质量是7.3克,②该盐酸的实际质量分数是29.2%,③:盐酸有挥发性.④HCl、NaCl.
点评:本题是对溶液及方程式计算题的考查,找到已知量利用化学方程式求出所需的量,进而再利用溶质的质量分数的计算进行求解,完成此题对培养学生分析问题及计算能力有一定帮助.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
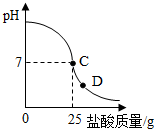 出加入盐酸的质量与烧杯中溶液pH的关系如图.
出加入盐酸的质量与烧杯中溶液pH的关系如图.