题目内容
【题目】含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途.
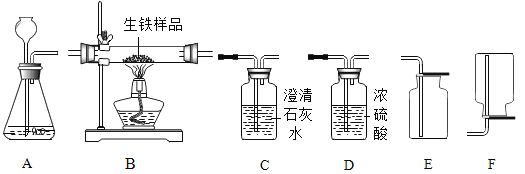
Ⅰ.以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO47H2O)的流程如图1.
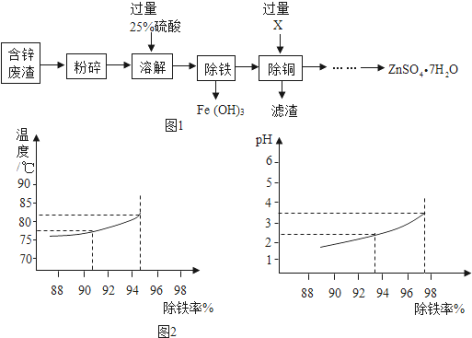
(1)粉碎的目的是________ .
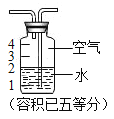
(2)若实验室用质量分数为98%的硫酸配制200g 25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、________和________, 此处玻璃棒的作用是________ .
(3)物质X是________, 滤渣中含有金属单质有________, 除铜时发生的反应属于________反应(填基本反应类型)
(4)流程中获得七水硫酸锌前省略的操作是________、冷却结晶、________、洗涤和低温烘干.
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化学式是________ .
(6)除铁过程中,温度、pH对除铁效果的影响分别如图2所示.由图可知,除铁时温度应控制在________℃为宜,pH应控制在________为宜.
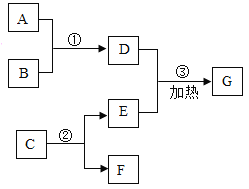
(7)以某菱锌矿(ZnCO3含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应):
ZnCO3![]() ZnO+CO2↑ ZnO+CO
ZnO+CO2↑ ZnO+CO![]() Zn+CO2 .
Zn+CO2 .
则100吨这样的菱锌矿理论上最多可制得锌多少吨_______?(写出计算过程)
【答案】增大反应物的接触面积,加快反应速率 量筒 烧杯 搅拌 锌 锌和铜 置换反应 加热浓缩 过滤 ![]() 82 3.5 32.5
82 3.5 32.5
【解析】
(1)含锌废渣粉碎,能增大反应物的接触面积,能加快反应速率,利于充分反应。
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,采用的加水稀释的方法,操作步骤是计算、量取、混匀,量筒与胶头滴管用于准确量取浓硫酸和水;烧杯用于完成混匀操作的容器;混匀时要防止局部过热造成液体飞溅,玻璃棒用于混匀时的搅拌。
(3)加入过量X的目的是除铜,同时得到硫酸锌溶液,锌能与硫酸铜溶液反应生成硫酸锌溶液和铜,过滤多余的锌和铜,得到硫酸锌溶液,故X是锌,该反应属于置换反应。
(4)流程中获得七水硫酸锌前省略的操作是加热条件下制成硫酸锌的饱和溶液、冷却结晶、过滤、洗涤和低温烘干。
(5)设铁的氧化物的化学式是![]() ,根据题意有:
,根据题意有:![]() ,所以该氧化物的化学式是
,所以该氧化物的化学式是![]() 。
。
(6)由图2可知,一定范围内,温度越高,除铁率越高;一定范围内,PH值越大,除铁率越高,再由图中曲线可知,除铁时温度应控制在82℃为宜,pH应控制在3.5为宜。
(7)设纯度为62.5%的100吨菱锌矿理论上最多可制得锌的质量为z,则
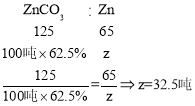
答:100吨这样的菱锌矿理论上最多可制得锌32.5吨。

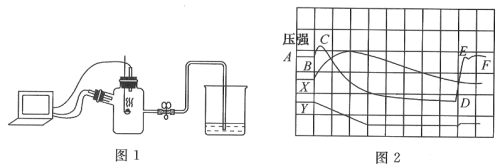
【题目】为了帮助同学们更好的理解空气中氧气含量测定的实验原理,老师利用传感器技术实时测定了实验装置(如图1)内的压强、温度和氧气浓度,三条曲线变化趋势如图2所示。
(1)红磷燃烧的化学反应符号表达式为________________________;
(2)X曲线表示的是____________(填“温度”或“氧气的浓度”);
(3)结合X、Y两条曲线,解释图2中BC段气压变化的原因是_________________________;
(4)实验中测得的数据如下:
测量 项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 烧杯中剩余水的体积 | 瓶中剩余气体的体积 | |
体积/mL | 80.0 | 46.4 | 126.0 |
根据实验数据计算:测得的空气中氧气的体积分数为________________(列出计算式即可)。