题目内容
实验室中有铁粉和氧化铜的混合物, 实验小组按如下流程处理该混合物。

写出上述混合物在加入过量硫酸过程中,一定发生反应的化学反应方程式: ,滤渣B的成分是 (填化学式)
写出生成气体的化学方程式是
滤液C中溶质的成分有 (填化学式)

写出上述混合物在加入过量硫酸过程中,一定发生反应的化学反应方程式: ,滤渣B的成分是 (填化学式)
写出生成气体的化学方程式是
滤液C中溶质的成分有 (填化学式)
⑴CuO + H2SO4= CuSO4 + H2O ,Fe + CuSO4= FeSO4 + Cu
(2)Cu
(3)Fe + H2SO4=FeSO4 + H2↑
(4)H2SO4; FeSO4;CuSO4(答对1个得1分)
(2)Cu
(3)Fe + H2SO4=FeSO4 + H2↑
(4)H2SO4; FeSO4;CuSO4(答对1个得1分)
试题分析:向氧化铜和铁粉的混合物中加入过量稀硫酸,氧化铜与硫酸反应生成硫酸铜和水;铁与硫酸反应生成硫酸亚铁和氢气;由题目给出的信息可知:向滤液C中加入适量铁,有气体产生,说明滤液C中一定含有硫酸;同时得到铜,说明滤液C中一定含有硫酸铜;也说明铁把硫酸铜中的铜置换出来,因此固体中一定有铜,而硫酸过量,氧化铜和铁能与硫酸反应,所以氧化铜和铁一定不剩余,故滤渣B中只含有铜;因为得到了铜,所以一定分数的反应是:CuO + H2SO4= CuSO4 + H2O ,Fe + CuSO4= FeSO4 + Cu

练习册系列答案
相关题目
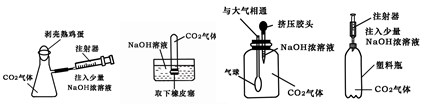
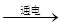 2NaOH + H2↑ + Cl2↑,
2NaOH + H2↑ + Cl2↑,