题目内容
【题目】将一定质量的铁粉加至H2SO4、MgSO4和CuSO4的混合溶液中,充分反应后过滤,得到滤液M和滤渣N.
(1)写出铁和稀H2SO4反应的化学方程式:_____.
(2)滤液M中一定含有的溶质是_____,滤渣N中一定含有的金属是_____.
(3)如果滤渣N的质量恰好等于加入铁粉的质量,则混合溶液中H2SO4和CuSO4的质量比为:_____.
【答案】Fe+H2SO4=FeSO4+H2↑ MgSO4和FeSO4 Cu 7:80
【解析】
(1)根据Fe与稀H2SO4反应,生成FeSO4和H2书写化学方程式;
(2)根据Fe与CuSO4溶液反应生成Cu和FeSO4溶液,与MgSO4不反应,进行分析,确定溶液溶质、滤渣的变化.
(3)根据铁和硫酸铜反应的化学方程式,由铜的质量可求出硫酸铜和铁的质量,进而求出与硫酸反应的铁的质量,最后根据铁和硫酸反应的方程式求出硫酸的质量,进而求得质量比。
(1)铁和稀H2SO4反应的化学方程式为Fe+H2SO4=FeSO4+H2↑;故填:Fe+H2SO4=FeSO4+H2↑;
(2)混合溶液中的CuSO4与Fe发生置换反应,得到Cu;Fe与稀硫酸反应生成FeSO4和H2;由于MgSO4不与Fe发生反应,所以滤液中还含有MgSO4;故滤液M中一定含有的溶质是MgSO4和FeSO4,滤渣N中一定含有的金属是Cu;故填:MgSO4和FeSO4;Cu;
(3)假设生成的铜的质量为6.4g,由题意可知,则参加反应的铁的质量为6.4g.
设与硫酸铜反应的铁的质量为x,所含CuSO4的质量为y.
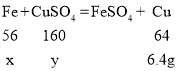
则![]() ,解得:x=5.6g,y=16g.
,解得:x=5.6g,y=16g.
那么与硫酸反应的铁的质量为:6.4g﹣5.6g=0.8g.
设混合溶液中所含H2SO4的质量为z
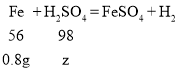
则![]() ,解得:z=1.4g.
,解得:z=1.4g.
混合溶液中所含H2SO4与CuSO4的质量比为:1.4g:16g═7:80