��Ŀ����
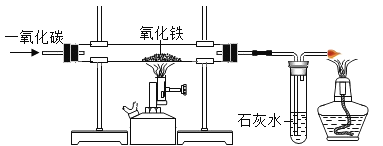
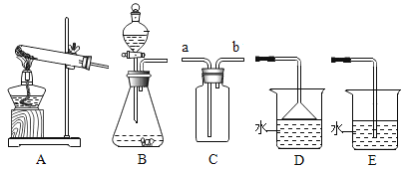
����Ŀ��ij�о���С����һ���¶��£�����ͼ��ʾ��ʵ��װ�ý���һ����̼��ԭ��������������ʵ�顣
(1)������ʵ��װ��(�Ѽ��������)�мӺ�ҩƷ�����Ӻ���������еĵ�һ��������____________��
(2)ʵ�鿪ʼ���Ҳ��Թ��з�����Ӧ�Ļ�ѧ����ʽΪ_______________________��
(3)�ӻ����Ƕȿ���ʵ��װ�ø���θĽ�?________________________________��
(4)ʵ���й۲쵽�������ڹ����ɺ���ɫȫ����Ϊ��ɫ���ֶԲ����ɫ��ĩA�ijɷֽ�������̽��:
���������ϣ���һ����̼��ԭ��������ʵ������й������������������������������������ۣ��������ʾ�Ϊ��ɫ;���������������������ͭ������Ӧ��
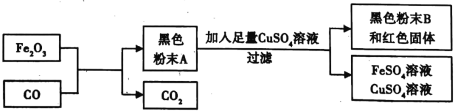
��������⣩��ɫ��ĩA������ʲô��?
�����в��룩(1)С����Ϊ��ɫ��ĩAȫ�������ۡ���С����ΪС���IJ����Ǵ���ģ�������______��
(2)С������˲���ٺͲ���ڣ�������ѧ֪ʶ�������µ�һ�����롣
�����:��ɫ��ĩA�����ۺ�����������(Fe3O4)���;
�����:��ɫ��ĩA�����ۺ���������(FeO)���:
�����:_______
���������ϣ������������ﶼ����ϡ�����ϡ���ᷴӦ�������������������ܱ���������;
��ʵ��̽����
���� | ʵ����� | ���ܵ����� | ���� |
�� | ȡ������ɫ��ĩA�ô������� | ��ɫ��ĩȫ�������� | �������ȷ |
�� | ȡ������ɫ��ĩA�ô������� | ��ɫ��ĩ���ֱ����� | �������ȷ |
�� | ________ | ______ | �������ȷ |
����˼���ۣ�(1)С����Ϊ�ڷ����٢��У�����________�Ľ�����ȷ��(�����ַ���)
(2)�����ڱ�������д��֤����IJ���۵�ʵ�����������
���ó����ۣ��ڸ����£�һ����̼����������Ӧ��������������������������������
���𰸡�ͨ��һ���һ����̼ Ca��OH��2+CO2�TCaCO3��+H2O ���ӵ�ȼ���ռ�β����װ�� ���ȫ�������ۣ�����ֺ�ɫ��ĩB ��ɫ��ĩA�����ۡ������������������������ ȡ������ɫ��ĩ���ô�������������ѱ��������������ʷ�����������ͭ��Һ�� ��ɫ��ĩ���ֱ�������������ɫ���壬��Һ����ɫ���dz��ɫ ��
��������
һ����̼�ж�����ɢ����������Ⱦ�������Ϳ�����������ϴﵽ��ը����ʱ����������ʱ�ᷢ����ը�����������£���������һ����̼��Ӧ���ɶ�����̼��������̼���������Ʒ�Ӧ���ɰ�ɫ����̼��ƺ�ˮ����������ͭ��Ӧ��������������ͭ��
��1��������ʵ��װ�ã��Ѽ�������ԣ��мӺ�ҩƷ�����Ӻ���������еĵ�һ��������ͨ��һ���һ����̼���ų�װ���еĿ�������ֹһ����̼�Ϳ�����ϼ���ʱ������ը��
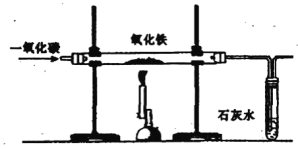
��2��ʵ�鿪ʼ����������һ����̼��Ӧ���ɶ�����̼���Ҳ��Թ��ж�����̼���������Ʒ�Ӧ����̼��Ƴ�����ˮ��������Ӧ�Ļ�ѧ����ʽΪ��Ca��OH��2+CO2�TCaCO3��+H2O��
��3���ӻ����Ƕȿ����������β���е�һ����̼���д�����һ����̼��ɢ�������л���Ⱦ���������Ӧ�����Ӵ���β����װ�ã��Ľ����������ӵ�ȼ���ռ�β����װ�ã�
[���в���]��1��С����ΪС���IJ����Ǵ���ģ����������ȫ�������ۣ�����ֺ�ɫ��ĩB��
��2������٣���ɫ��ĩA�����ۺ�������������Fe3O4����ɣ�
����ڣ���ɫ��ĩA�����ۺ�����������FeO����ɣ�
����ۣ���ɫ��ĩA�����ۡ�����������������������ɣ�
[ʵ��̽��]��ȡ������ɫ��ĩA�ô�����������ɫ��ĩȫ����������˵����ɫ����������������������
��ȡ������ɫ��ĩA�ô�����������ɫ��ĩ���ֱ�������˵�������к�������������
��ȡ������ɫ��ĩ���ô�������������ѱ��������������ʷ�����������ͭ��Һ�У�
ʵ������ɫ��ĩ���ֱ�������˵�������к�������������������ɫ���壬��Һ����ɫ���dz��ɫ������Ϊ��������ͭ��Ӧ��������������ͭ��ʣ���ɫ���壬˵�������к���������������
[��˼����]��1��С�ڷ����٢��У������ٵĽ�����ȷ��������Ϊ��ɫ��ĩȫ����������˵����ɫ������������������������ɫ��ĩ���ֱ�������˵����ɫ������������ۺ�����������Ҳ���������ۡ�������������������������˷����ڵĽ�����ȷ��

 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д� ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�����Ŀ����һС������ɫ�Ľ����Ʒ����ڿ����лᷢ�����б仯��
![]()
��������⣩����������������Ӧ����������Щ��
���������ϣ��Ƶ��������������(Na2O)��й�������(Na2O2)����������������ƶ�����ˮ������Ӧ������ʽ���£�Na2O+H2O=2NaOH��2Na2O2+2H2O=4NaOH+O2��
���������룩����������������Ӧ�IJ��
����1��Na2O�� ����2��Na2O2�� ����3:_______��
��ʵ��̽��һ��
ʵ����� | ʵ������ | ʵ����� |
ȡ�����Ƶ������������������ˮ | ��_____�� | ����1��ȷ |
������̽�������ڿ����з���һ��ʱ��õ���ɫ����ijɷ�
���������룩����һ��Na2CO3�������Na2CO3��NaOH
��ʵ��̽������
ʵ����� | ʵ������ | ʵ����� |
1��ȡ������ɫ�����������_____�� | ������ɫ���� | ��ɫ����ɷ�ΪNa2CO3��NaOH |
2�����ˡ�ȡ������Һ�����̪�� | ��______�� |
��ʵ�鷴˼��
(1)���������������ķ�Ӧ��д�������������ᷴӦ�Ļ�ѧ����ʽ_______��
(2)��������Ҳ�������ᷴӦ������ʽΪ��2Na2O2+4HCl=4NaCl+2H2O+X��X�Ļ�ѧʽΪ______��
(3)�����ᷴӦֻ�����κ�ˮ���������Ϊ������������ж�Na2O2___����������(������������������)��
����Ŀ����������ʦ����ѧ��̽���������غ㶨�ɡ��Ľ�ѧƬ�Σ��������̽������æ��д�ո�(�������еĿո�)��
��������⣩��ѧ��Ӧǰ������ʵ������ܺ��Ƿ���ȣ�
����������裩����1������ȣ�����2����ȡ�
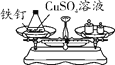
��ʵ��̽�����ס�������ͬѧ��������ƽ�ֱ������Ӧǰ�����ʵ�������
���� | ���� | |
ʵ�鷽��(��Ӧ����) |
|
|
ʵ������ | �����ݲ�������ƽָ������ƫת | ���������к�ɫ������������Һ��ɫ�����ı䣬��ƽָ��û��ƫת |
���� | ����1��ȷ��Ӧ�Ļ�ѧ����ʽ��_____ | ����2��ȷ |
����˼���ۣ��������ֲ�����ȷ��ͨ�����ۣ�ͬѧ�Ƿ��ּ��������������������ָ������ƫת���õ���ʾ����̽����ѧ��Ӧǰ������ʵ������ܺ��Ƿ����ʱ�������������ɻ�μӵķ�Ӧһ��Ҫ��_____�н��С�
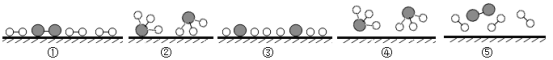
���Ż�װ�ã�ͬѧ�ǶԼ��������еķ�Ӧװ�ý������������ָĽ�������Ϊ���װ����_____ (�����)������������װ������ѡһ��ָ���䲻��_____��
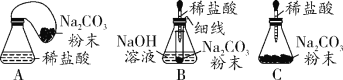
���ó����ۣ�ͬѧ�����øĽ�������װ�ý����ٴ�̽�������ó�����2��ȷ����һ���������֣���Ӧ��ϵ�����IJμӻ�ѧ��Ӧ��δ�μӷ�Ӧ�����ʵ������ڷ�Ӧǰ�ֲ��䣬���յó����ۣ�_______�ĸ����ʵ������ܺ͵��ڷ�Ӧ�����ɵĸ����ʵ������ܺ͡�
������Ӧ�ã����ͣ���ѧ��Ӧǰ��ԭ�ӵ����ࡢ��Ŀ�����������䣬���������غ㡣
Ӧ�ã�ij�����������Ȼᷢ���ֽⷴӦ����������ͭ��ˮ�Ͷ�����̼�������ʣ���ù�������һ����_____��Ԫ����ɡ�