题目内容
【题目】(1)请用化学用语填空:
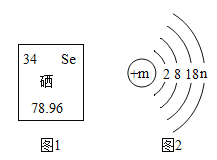
①3个氖原子_____;
②氯化钠中的阳离子_____;
③保持氮气化学性质的最小粒子_____;
④过氧化氢中氢元素的化合价_____;
(2)现有7种物质:①液氧②碳酸氢铵③澄清石灰水④洁净的空气⑤冰水混合物⑥锰酸钾⑦氧化镁。其中属于混合物的是_____;(填序号,下同),属于纯净物的是_____;属于单质的是_____。
【答案】3Ne Na+ N2 ![]() ③④ ①②⑤⑥⑦ ①
③④ ①②⑤⑥⑦ ①
【解析】
(1)①氖原子的符号为Ne,3个氖原子为“3Ne”;②氯化钠中的阳离子为钠离子,钠离子表示为“Na+”;③保持氮气化学性质的最小粒子是氮分子,是由两个氮原子构成,表示为“N2”;④过氧化氢中氢元素的化合价未+1价,表示为“![]() ”;
”;
(2)属于纯净物的是液氧、碳酸氢铵、冰水混合物、锰酸钾、氧化镁;混合物的是澄清石灰水、洁净的空气;属于单质的是液氧;
故答案为:3Ne;Na+;N2;![]() ;③④;①②⑤⑥⑦;①。
;③④;①②⑤⑥⑦;①。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】小亮同学想通过实验探究某企业采用的氨碱法制的纯碱样品的成分及含量。
[提出问题1]①该纯碱样品中含有哪些物质?
[猜想与假设]通过分析,小亮做出如下假设:
(1)只含有Na2CO3;(2)含有Na2CO3和NaHCO3
[查阅资料]
NaHCO3 | Na2CO3 | |
加入稀盐酸 | 现象I | 产生气泡 |
加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(1)表中的现象Ⅱ为___________;
(2)现象I对应的化学方程式为_________。
[实验探究]为了确定纯碱样品的成分,小亮设计如下实验方案,请你一起完成下列实验报告。
实验步骤 | 实验现象 | |
①取少量样品溶于水,加入过量的CaCl2溶液 | 溶液变浑浊 | 该反应的化学方程式:___________; |
②将上述反应后的混合液过滤,取滤液_______; | _______; | 证明猜想②成立。 |
[实验反思]
实验步骤①中,加入试剂过量的目的是_______;
[提出问题2]如何测量该纯碱样品中各物质的含量?

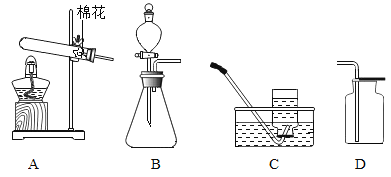
(1)为测量该纯碱样品各成分的含量,小亮设计了如图装置,通过称量B装置中的质量变化来确定样品中各成分的含量。该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差。造成偏差的原因有
①__________;②__________;
(2)小亮在老师的指导下重新设计了如下的实验装置。该实验有以下操作步骤:

①检查装置气密性;②将w g干燥的样品放入锥形瓶中;
③称量盛有氢氧化钠浓溶液的B瓶质量;
④打开活塞b,从导管a处缓缓注入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量计算样品中各成分的含量。
该实验的正确步骤是___________;