题目内容
【题目】欲测定某生石灰中碳酸钙的质量分数,进行了如图实验.请计算: 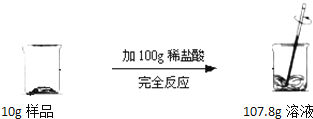
(1)生成CO2气体的质量是 g;
(2)求样品中CaCO3的质量分数.(列化学方程式计算)
【答案】
(1)2.2
(2)
设样品中CaCO3的质量为X,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
X 2.2g
![]()
X=5g,
样品中CaCO3的质量分数为: ![]() ×100%=50%.
×100%=50%.
答:样品中CaCO3的质量分数为50%.
【解析】【解答解:(1)反应前后的质量差即是生成的二氧化碳的质量,生成的二氧化碳的质量为:10g+100g﹣107.8g=2.2g,
答:生成CO2气体的质量为2.2g.
2)设样品中CaCO3的质量为X,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
X 2.2g![]()
X=5g,
样品中CaCO3的质量分数为: ![]() ×100%=50%.
×100%=50%.
答:样品中CaCO3的质量分数为50%.
根据反应前后的质量差可以求出生成二氧化碳的质量,根据二氧化碳的质量可以求出碳酸钙的质量.
【考点精析】掌握根据化学反应方程式的计算是解答本题的根本,需要知道各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目