题目内容
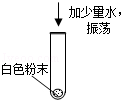
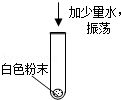
【题目】某同学做实验时发现,盛放NaOH溶液的瓶口与橡皮塞上,常有白色粉末出现.为探究这种白色粉末的成分,设计了如下实验.请你完成实验报告.
实验步骤 | 实验现象 | 结论和反应的化学方程式 |
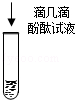
1)、 | 白色粉末溶于水,形成无色溶液. | / |
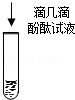
2)、 | 酚酞变红. | 溶液呈碱性,含有离子. |
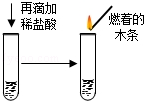
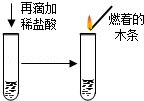
3)、 | 溶液由红色变为无色,并有气泡产生.产生的气体能使燃着的木条熄灭. | 溶液中含有 . |
该实验证明氢氧化钠已经变质,有关方程式 .
【答案】OH-离子|CO32-离子|Na2CO3 |Na2CO3+2HCl=2NaCl+H2O+CO2↑
【解析】解:2、溶液能使酚酞变红,说明溶液中含有氢氧根离子而呈碱性;3、管口燃烧的木条熄灭,说明滴入稀盐酸反应放出了不支持燃烧的气体;由于氢氧化钠吸收二氧化碳可生成碳酸钠,碳酸钠又可与盐酸反应放出不支持燃烧的二氧化碳气体,因此根据滴入盐酸后管口燃烧的木条熄灭的现象,可判断溶液中含有碳酸钠溶解时电离出的碳酸根离子;碳酸钠与盐酸反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
故答案为:
实验步骤 | 实验现象 | 结论和反应的化学方程式 |
1)、 | 白色粉末溶于水,形成无色溶液. | / |
2)、 | 酚酞变红. | 溶液呈碱性,含有 OH一离子. |
3)、 | 溶液由红色变为无色,并有气泡产生.产生的气体能使燃着的木条熄灭. | 溶液中含有 CO32一离子. 白色粉末中有氢氧化钠变质生成的 Na2CO3产生气体的方程式为 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑.
氢氧化钠溶液吸收空气中二氧化碳可生成碳酸钠,碳酸钠溶于水形成的碳酸钠溶液呈碱性,碳酸钠能与盐酸反应放出二氧化碳气体,二氧化碳不支持燃烧而使放在管口的燃烧的木条熄灭.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】下表列出了一些常见物质在常温下的pH范围,说法正确是 ( )
物质名称 | 肥皂水 | 牛奶 | 葡萄汁 | 苹果汁 |
pH范围 | 9.6~ 10.0 | 6.3~6.6 | 3.5~4.5 | 2.9~3.3 |
A.肥皂水和牛奶显碱性
B.葡萄汁比苹果汁酸性强
C.肥皂水加水稀释,溶液pH升高
D.胃酸过多的人不适合多饮苹果汁