题目内容
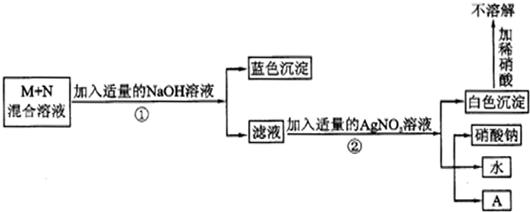
某溶液中含有Cu(N03)2、Ba(N03)2、AgN03三种溶质,为使上述三种物质 分别转化为沉淀,并将沉淀逐一分离出来,现提供Na2CO3.溶液、盐酸溶液和NaOH溶液三种试剂,要求每次只加一种试剂滤出一种沉淀,那么所加试剂先后顺序是________.
盐酸、氢氧化钠、Na2CO3
分析:先分析Cu(N03)2、AgN03、Ba(N03)2三种物质与①Na2C03溶液、②稀盐酸、③NaOH溶液三种试剂的反应情况,再据使Cu(N03)2、AgN03、Ba(N03)2三种溶质中的阳离子分步沉淀出来,分析第一种物质必须只沉淀一种阳离子,第二种物质只能与剩余的两种物质中的一种阳离子反应生成沉淀
解答:Na2C03溶液能将Cu(N03)2、AgN03、Ba(N03)2三种溶质中的阳离子全部沉淀依次生成碳酸铜沉淀、碳酸银沉淀、碳酸钡沉淀,又因要将Cu(N03)2、AgN03、Ba(N03)2三种溶质中的阳离子分步沉淀出来,故①Na2C03溶液只能放在最后,②稀盐酸只与硝酸银反应产生氯化银白色沉淀,故先选用②稀盐酸,③NaOH溶液能与Cu(N03)2、Ba(N03)2中的硝酸铜反应生成蓝色氢氧化铜沉淀,然后再用碳酸钠沉淀钡离子.
故答案:盐酸、氢氧化钠、Na2CO3.
点评:本题考查了盐的性质,利用盐的性质将他们分步沉淀,考查了分析问题和解决问题的能力.
分析:先分析Cu(N03)2、AgN03、Ba(N03)2三种物质与①Na2C03溶液、②稀盐酸、③NaOH溶液三种试剂的反应情况,再据使Cu(N03)2、AgN03、Ba(N03)2三种溶质中的阳离子分步沉淀出来,分析第一种物质必须只沉淀一种阳离子,第二种物质只能与剩余的两种物质中的一种阳离子反应生成沉淀
解答:Na2C03溶液能将Cu(N03)2、AgN03、Ba(N03)2三种溶质中的阳离子全部沉淀依次生成碳酸铜沉淀、碳酸银沉淀、碳酸钡沉淀,又因要将Cu(N03)2、AgN03、Ba(N03)2三种溶质中的阳离子分步沉淀出来,故①Na2C03溶液只能放在最后,②稀盐酸只与硝酸银反应产生氯化银白色沉淀,故先选用②稀盐酸,③NaOH溶液能与Cu(N03)2、Ba(N03)2中的硝酸铜反应生成蓝色氢氧化铜沉淀,然后再用碳酸钠沉淀钡离子.
故答案:盐酸、氢氧化钠、Na2CO3.
点评:本题考查了盐的性质,利用盐的性质将他们分步沉淀,考查了分析问题和解决问题的能力.

练习册系列答案
相关题目
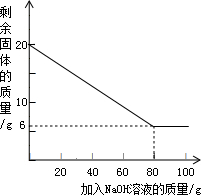 已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2A1+2H2O+2NaOH═2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2A1+2H2O+2NaOH═2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.取20g该金属粉末,把100g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象:
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
(2)该金属粉末中Al的质量分数为
(3)列式计算:所用氢氧化钠溶液的溶质质量分数为多少?(精确到0.1%).
金属是现代生活和工业生产中应用极为普遍的一类材料.
已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.
(查阅资料)Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
①请完成证明金属粉末中存在Fe和Cu的实验设计:
②为探究该金属粉末中Al的质量分数,取20g该金属粉末,把100g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
I.分析以上数据可知上表中n的值为 ;
II.该金属粉末中Al的质量分数为 %;
III.列式计算:所用氢氧化钠溶液的溶质质量分数为多少?
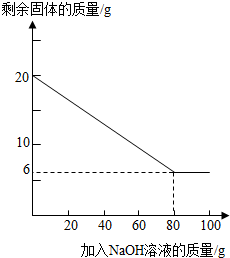
已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.
(查阅资料)Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
①请完成证明金属粉末中存在Fe和Cu的实验设计:
| 实验操作 | 实验现象 | 结论 |
| Ⅰ取少量的金属粉末于试管中,加入足量的________________(填试剂名称). | _____________. | 仅除去铝 |
| Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸. | _____________. | 证明含有铁 |
| Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
II.该金属粉末中Al的质量分数为
III.列式计算:所用氢氧化钠溶液的溶质质量分数为多少?

 都在5%以上.请设计实验探究该粉末中铁、铜的存在.
都在5%以上.请设计实验探究该粉末中铁、铜的存在.