题目内容
某校兴趣小组对氢氧化钠溶液与稀硫酸混合后的有关问题,进行了如下探究,请同学们一起参与此次探究之旅.
(1)实验一:判断氢氧化钠溶液与稀硫酸混合后是否恰好完全中和?
[方案设计]小亮、小丽、小林三位同学设计了如下方案进行探究:
[方案评价]请判断以上设计的三个方案中,
[方案反思]请分析另外两个方案错误的原因:
(2)实验二:将氢氧化钠和硫酸钠的混合物11.8g放入88.2g水中使其完全溶解,再加入100g溶质质量分数为9.8%的硫酸溶液,恰好完全反应.
试计算:①原混合物中氢氧化钠的质量;
②反应后所得溶液中溶质的质量分数.
(1)实验一:判断氢氧化钠溶液与稀硫酸混合后是否恰好完全中和?
[方案设计]小亮、小丽、小林三位同学设计了如下方案进行探究:
| 方案设计者 | 方案步骤 | 方案预估现象 | 方案预估结论 |
| 小亮 | 取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡 | 酚酞试液不变色 | 恰好完全中和 |
| 小丽 | 用一根洁净的玻璃棒蘸取反应后的溶液沾在pH试纸上,把试纸呈现的颜色与标准比色卡对照 | pH=7 | 恰好完全中和 |
| 小林 | 取少量反应后的溶液于一支试管中,并向试管中滴加硝酸钡溶液和稀硝酸溶液 | 有白色沉淀生成 | 硫酸过量,没有完全中和 |
小丽
小丽
同学的方案是正确的.[方案反思]请分析另外两个方案错误的原因:
硫酸和硫酸钠都不能使酚酞变色;所以不能仅仅根据酚酞不变色就判断反应恰好完全
硫酸和硫酸钠都不能使酚酞变色;所以不能仅仅根据酚酞不变色就判断反应恰好完全
、硫酸和硫酸钠都能和硝酸银反应生成白色沉淀,所以不能仅仅根据产生了白色沉淀就判断硫酸过量
硫酸和硫酸钠都能和硝酸银反应生成白色沉淀,所以不能仅仅根据产生了白色沉淀就判断硫酸过量
.(2)实验二:将氢氧化钠和硫酸钠的混合物11.8g放入88.2g水中使其完全溶解,再加入100g溶质质量分数为9.8%的硫酸溶液,恰好完全反应.
试计算:①原混合物中氢氧化钠的质量;
②反应后所得溶液中溶质的质量分数.
分析:(1)【方案评价】硫酸和氢氧化钠溶液反应生成了硫酸钠和水,其中硫酸和硫酸钠都不能使酚酞变色;可以据此解答该题;【方案反思】根据硫酸呈酸性,而硫酸钠呈中性,并且硫酸和硫酸钠都能和硝酸银反应生成微溶物(白色沉淀),可以据此解答;(2)根据硫酸的质量计算出氢氧化钠的质量,在计算硫酸钠时有两部分.
解答:解:(1)【方案评价】硫酸和氢氧化钠溶液反应生成了硫酸钠和水,硫酸钠溶液为中性溶液,其pH值等于7,所以可以判断小丽的方案是正确的;
【方案反思】根据硫酸呈酸性,而硫酸钠呈中性,其中硫酸和硫酸钠都不能使酚酞变色;所以不能仅仅根据酚酞不变色就判断反应恰好完全.硫酸和硫酸钠都能和硝酸银反应生成白色沉淀,所以不能仅仅根据产生了白色沉淀就判断硫酸过量;
(2)2NaOH+H2SO4 ═Na2SO4+2H2O
80 98 142
X 100g×9.8% Y
根据:
=
解得X=8g;根据:
=
解得Y=14.2g,反应前硫酸钠的质量为:11.8g-8g=3.8g,反应后溶液质量:11.8g+88.2g+100g=200g,所以反应后所得溶液中溶质的质量分数:=
×100%=9%.
故答案为:(1)小丽;硫酸和硫酸钠都不能使酚酞变色;所以不能仅仅根据酚酞不变色就判断反应恰好完全;硫酸和硫酸钠都能和硝酸银反应生成白色沉淀,所以不能仅仅根据产生了白色沉淀就判断硫酸过量;(2)①8g;②9%.
【方案反思】根据硫酸呈酸性,而硫酸钠呈中性,其中硫酸和硫酸钠都不能使酚酞变色;所以不能仅仅根据酚酞不变色就判断反应恰好完全.硫酸和硫酸钠都能和硝酸银反应生成白色沉淀,所以不能仅仅根据产生了白色沉淀就判断硫酸过量;
(2)2NaOH+H2SO4 ═Na2SO4+2H2O
80 98 142
X 100g×9.8% Y
根据:
| 80 |
| 98 |
| X |
| 100g×9.8% |
| 98 |
| 142 |
| 100g×9.8% |
| Y |
| 14.2g+3.8g |
| 200g |
故答案为:(1)小丽;硫酸和硫酸钠都不能使酚酞变色;所以不能仅仅根据酚酞不变色就判断反应恰好完全;硫酸和硫酸钠都能和硝酸银反应生成白色沉淀,所以不能仅仅根据产生了白色沉淀就判断硫酸过量;(2)①8g;②9%.
点评:要想解答好这类题目,首先,要理解和熟记中和反应及其应用等相关知识.然后,根据所给的实验、问题情景等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意等各种信息资源,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
相关题目
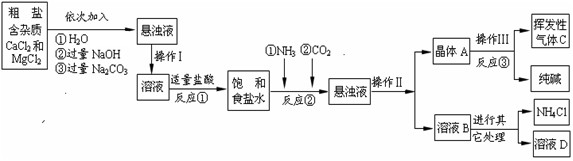
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【产品与原理】
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【生产流程】
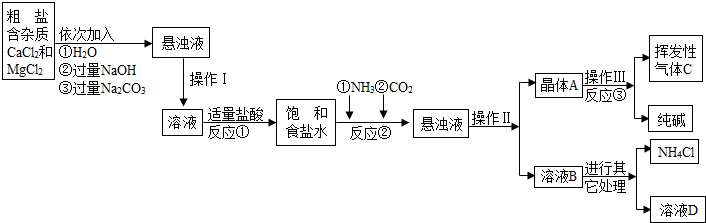
【相关资料】
(1)NH4Cl
NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下
(气体指1体积水中能溶解的气体体积)
【问题讨论】:
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为 .
(2)反应①中发生了两个反应,写出其中的一个化学方程式:
.
(3)反应③中得到纯碱的化学方程式为: .
(4)溶液B中的溶质有 (至少写出两种).
(5)上述生产流程中可循环使用的是 (填序号).
A.挥发性气体C; B.溶液D; C.氢氧化镁;D.化肥NH4Cl
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质 (写化学式).
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,
请通过计算并结合右表判断此纯碱样品等级为 品.
【计算过程】
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 .
【产品与原理】
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:
NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【生产流程】

【相关资料】
(1)NH4Cl
| ||
(2)已知20℃时有关物质的溶解度如下
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
【问题讨论】:
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为
(2)反应①中发生了两个反应,写出其中的一个化学方程式:
(3)反应③中得到纯碱的化学方程式为:
(4)溶液B中的溶质有
(5)上述生产流程中可循环使用的是
A.挥发性气体C; B.溶液D; C.氢氧化镁;D.化肥NH4Cl
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,
请通过计算并结合右表判断此纯碱样品等级为
【计算过程】
| 工业纯碱标准:(Na2CO3≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
产品与原理:
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为: ;分离出NaHCO3,加热制得纯碱.
生产流程: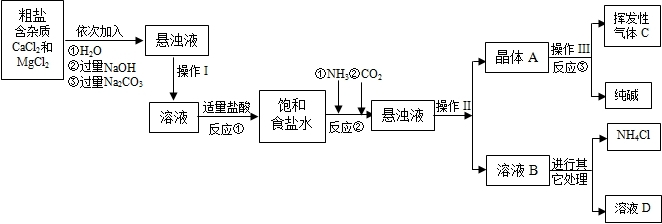
相关资料:
(1)NH4Cl
NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
问题讨论:
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为 .
(2)反应①中发生了两个反应,写出这两个化学方程式:① ;② .
(3)反应③中得到纯碱的化学方程式为: .
(4)溶液B中的溶质有 (至少写出两种).
(5)上述生产流程中可循环使用的是 (填序号).
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
(6)检验挥发性气体C的方法 .
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质 (写化学式).
含量测定:
工业纯碱标准:(Na2CO3%≥)优等品一等品合格品99.298.898.0
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算并结合右表判断此纯碱样品等级为 品.
计算过程:
总结反思:
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 .
产品与原理:
该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.
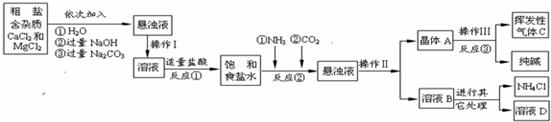
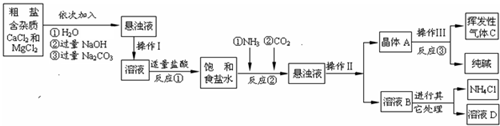
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为:
生产流程:

相关资料:
(1)NH4Cl
| ||
(2)已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为
(2)反应①中发生了两个反应,写出这两个化学方程式:①
(3)反应③中得到纯碱的化学方程式为:
(4)溶液B中的溶质有
(5)上述生产流程中可循环使用的是
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
(6)检验挥发性气体C的方法
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质
含量测定:
工业纯碱标准:(Na2CO3%≥)优等品一等品合格品99.298.898.0
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算并结合右表判断此纯碱样品等级为
计算过程:
总结反思:
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是
 NH3↑+HCl↑
NH3↑+HCl↑
