题目内容
【题目】某工厂用CaSO4悬浊液、NH3和CO2制备(NH4)2SO4,其工艺流程如下:
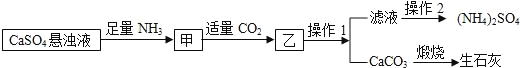
(1)先通氨气再通二氧化碳的原因 。
(2)硫酸铵在农业生产中的用途是____________,写出利用该流程制备(NH4)2SO4的化学方程式:_______________________________________________________________。
(3)通过查阅溶解度曲线知(NH4)2SO4的溶解度随温度变化较大,那么提纯滤液以获得(NH4)2SO4晶体,必要的操作2中包含步骤有____________。
A.蒸干 B.蒸发 C.冷却结晶 D.过滤
(4)上述生成流程中,有关NH3的作用及说明正确的是______________。
A.提供制备所需的氮元素
B.增大CO32-的浓度促进反应发生
C.作反应的催化剂
D.生产132g(NH4)2SO4,至少消耗34g NH3
【答案】(1) 氨气在水中的溶解度比二氧化碳大,先通氨气形成碱性的氨的水溶液,易于吸收更多的二氧化碳,从而提高产率 。
(2) 化肥 , CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3 。
(3) BCD 。
(4) ABD
【解析】
试题分析:(1)氨气是碱性气体,二氧化碳是酸性气体,氨气在水中的溶解度比二氧化碳大,易于多吸收二氧化碳,从而提高产率 (2)硫酸铵是一种含有氮元素的肥料 ,根据质量守恒定律,该反应的化学方程式是: CaSO4+H2O+CO2+2NH3= CaCO3+(NH4)2SO4 (3)(NH4)2SO4的溶解度受温度影响较大,则用降温结晶法使(NH4)2SO4从溶液中结晶析出,然后过滤,再蒸发(NH4)2SO4饱和溶液中的溶剂,使 (NH4)2SO4从溶液中结晶析出。 (4)A.提供制备所需的氮元素,正确; B.增大CO32-的浓度促进反应发生 ,正确;C.在该反应中是反应物,错误; D.设生产132g(NH4)2SO4,至少消耗NH3的质量是x , CaSO4+H2O+CO2+2NH3= CaCO3+(NH4)2SO4
2×17 132
x 132g
2×17 : 132= x : 132g 解得x=34g
正确,故选ABD