题目内容
(2009?资阳)准确量取密度为1.84g/mL、质量分数为98%的浓硫酸12.0mL,加水(密度为1.0g/mL)77.9mL进行稀释.
计算:(计算结果均保留1位小数)
(1)稀释后硫酸溶液的质量分数是多少?
(2)滴加NaOH溶液中和稀释后的硫酸溶液,当混合溶液pH等于7时,发生反应的NaOH的质量是多少?
计算:(计算结果均保留1位小数)
(1)稀释后硫酸溶液的质量分数是多少?
(2)滴加NaOH溶液中和稀释后的硫酸溶液,当混合溶液pH等于7时,发生反应的NaOH的质量是多少?
分析:(1)根据m=ρV,可由浓硫酸的体积和密度计算浓硫酸溶液的质量;利用溶质质量=溶液质量×溶液的质量分数,计算溶液中溶质的质量;加水稀释时,溶液中溶质质量不变,利用此等量关系,可根据浓硫酸的质量计算出加水稀释后硫酸的溶质质量分数.
(2)依据硫酸的质量结合硫酸与氢氧化钠的反应方程式可计算当混合溶液pH等于7时(恰好反应)时氢氧化钠的质量;
(2)依据硫酸的质量结合硫酸与氢氧化钠的反应方程式可计算当混合溶液pH等于7时(恰好反应)时氢氧化钠的质量;
解答:解:(1)1.84g/cm3=1.84g/mL.
设稀释后硫酸溶液的质量分数是x,则
12mL×1.84g/mL×98%=(12mL×1.84 g/mL+77.9mL×1.0g/mL)×x
x≈21.6%
(2)当混合溶液pH等于7时说明氢氧化钠恰好与稀硫酸反应;此溶液中硫酸的质量是12mL×1.84g/mL×98%≈21.6g
设发生反应的NaOH的质量是x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 21.6g
=
x≈17.6g
答:(1)稀释后硫酸溶液的质量分数是21.6%;(2)滴加NaOH溶液中和稀释后的硫酸溶液,当混合溶液pH等于7时,发生反应的NaOH的质量是17.6g;
设稀释后硫酸溶液的质量分数是x,则
12mL×1.84g/mL×98%=(12mL×1.84 g/mL+77.9mL×1.0g/mL)×x
x≈21.6%
(2)当混合溶液pH等于7时说明氢氧化钠恰好与稀硫酸反应;此溶液中硫酸的质量是12mL×1.84g/mL×98%≈21.6g
设发生反应的NaOH的质量是x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 21.6g
| 80 |
| x |
| 98 |
| 21.6g |
x≈17.6g
答:(1)稀释后硫酸溶液的质量分数是21.6%;(2)滴加NaOH溶液中和稀释后的硫酸溶液,当混合溶液pH等于7时,发生反应的NaOH的质量是17.6g;
点评:本题考查了有关溶质质量分数的有关计算,完成此题,可以依据溶质质量分数公式以及化学方程式的计算进行.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
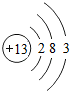 ,铝原子核内中子数比质子数多1,则铝原子的中子数为
,铝原子核内中子数比质子数多1,则铝原子的中子数为