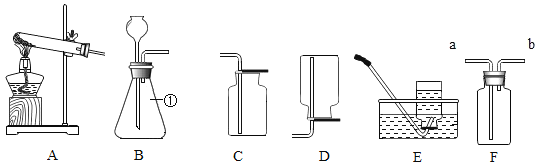
题目内容
【题目】如图是元素周期表的一部分,试回答下列问题:
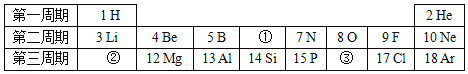
(1)画出①所示的原子结构示意图_____。
(2)氯离子的最外层电子数是_____。
(3)②所示元素与③所示元素形成化合物的化学式是_____。
(4)食用“加铁酱油”可预防贫血,其中的“铁”是指_____(填“元素”或“原子”)。
(5)地壳中含量最多的非金属元素位于周期表的第_____周期。
【答案】 8 Na2S 元素 二
8 Na2S 元素 二
【解析】
(1)①所示的原子是碳原子,结构示意图为 。
。
(2)氯离子是氯原子得到一个电子形成的,故最外层电子数是8。
(3)②所示元素是钠元素,③所示元素是硫元素,形成化合物是硫化钠,化学式是Na2S。
(4)元素组成物质,食用“加铁酱油”可预防贫血,其中的“铁”是指元素。
(5)地壳中含量最多的非金属元素是铝元素,位于周期表的第二周期。

【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如下表所示。若一定量石油产品中残余硫酸的质量为100 g,请计算该残余硫酸的溶质质量分数________________(写出详细的计算过程)。
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的pH |
① | 30 g | pH<7 |
② | 40 g | pH=7 |
③ | 50 g | pH>7 |
【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。
(猜想与假设)影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类。
(实验记录)同学们进行6组实验,实验记录如下:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | 0.5g NaCl | 0.5g FeCl3 | ||||
60分内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是________mL。
(2)实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定__________来比较过氧化氢的分解速率。
(3)得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是__________(填序号)。
(4)通过实验①、②、④可得出的结论是_______________。
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是____________、____________(答两点)。
(6)你认为影响过氧化氢溶液分解速率的因素还有哪些?请设计实验验证你的猜想
(猜想假设)___________________。
(实验操作)___________________。
(实验结论)___________________。