题目内容
氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:2NaCl+2H2O Cl2↑+H2↑+2NaOH.现取100g的溶质质量分数为25%的氯化钠溶液进行电解,一段时间后停止通电,生成氯气的质量7.1g.
Cl2↑+H2↑+2NaOH.现取100g的溶质质量分数为25%的氯化钠溶液进行电解,一段时间后停止通电,生成氯气的质量7.1g.
请计算:
(1)生成氢气的质量是多少?剩余氯化钠的质量是多少?
(2)反应后溶液中NaOH的质量分数是多少?
解:(1)设生成氢气的质量为x,剩余氯化钠的质量为y,生成氢氧化钠的质量z.
2NaCl+2H2O Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH
117 71 2 80
100g×25%-y 7.1g x z
 =
= =
=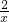 =
=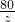
x=0.2g,y=13.3g,z=8g
(2)反应后溶液中氢氧化钠的质量分数为
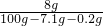 ×100%=8.63%
×100%=8.63%
答:(1)生成氢气0.2g,剩余氯化钠13.3g.
(2)反应后所得溶液中氢氧化钠的质量分数是8.63%.
分析:(1)由氯气的质量根据化学方程式可以计算出剩余氯化钠和生成氢气、氢氧化钠的质量.
(2)由氢氧化钠的质量和反应后溶液的质量可以计算出反应后溶液中氢氧化钠的质量分数.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
注意:计算反应后溶液质量时,用反应前溶液质量减去生成气体的质量时,不但要减去氯气的质量,还要减去氢气的质量.
2NaCl+2H2O
 Cl2↑+H2↑+2NaOH
Cl2↑+H2↑+2NaOH117 71 2 80
100g×25%-y 7.1g x z
 =
= =
=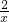 =
=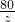
x=0.2g,y=13.3g,z=8g
(2)反应后溶液中氢氧化钠的质量分数为
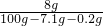 ×100%=8.63%
×100%=8.63%答:(1)生成氢气0.2g,剩余氯化钠13.3g.
(2)反应后所得溶液中氢氧化钠的质量分数是8.63%.
分析:(1)由氯气的质量根据化学方程式可以计算出剩余氯化钠和生成氢气、氢氧化钠的质量.
(2)由氢氧化钠的质量和反应后溶液的质量可以计算出反应后溶液中氢氧化钠的质量分数.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.
注意:计算反应后溶液质量时,用反应前溶液质量减去生成气体的质量时,不但要减去氯气的质量,还要减去氢气的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
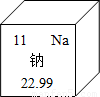
 (2013?朝阳区一模)钠元素对人类生命和生活具有重要意义.
(2013?朝阳区一模)钠元素对人类生命和生活具有重要意义.
 钠元素对人类生命和生活具有重要意义.
钠元素对人类生命和生活具有重要意义.