题目内容
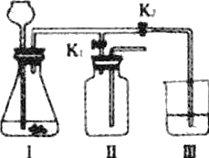
【题目】某化学兴趣小组利用下图装置探究制取气体的原理、方法及性质。结合装置图,回答下列问题:
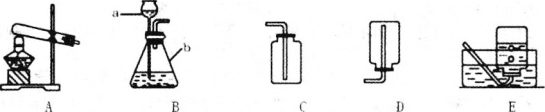
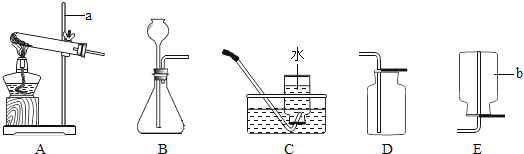
(1)写出图中标号仪器的名称:a________,b________。
(2)实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),应选择的发生装置是________(填上图字母)。
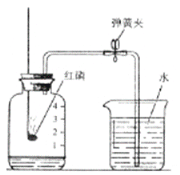
(3)该小组设计了如图所示的实验装置,既可用于制取气体,又可用于探究物质性质,①当打开K1、关闭K2时,利用Ⅰ和Ⅱ装置,可进行的实验是________(填字母)。并解释原因________。
a.大理石与稀盐酸反应制取二氧化碳;b.锌与稀硫酸反应制取氢气
②当打开K2、关闭K1时,可以利用Ⅰ和Ⅲ装置制得二氧化碳并验证其性质。实验室制取二氧化碳的化学方程式是________;若要证明二氧化碳能与水发生反应,应向烧杯的水中加入________。
(4)用石灰石浆吸收废气中的二氧化硫,其反应原理是:2CaCO3+O2+2SO2![]() 2CaSO4+2CO2。若1000kg废气中含有1.6kg的二氧化硫,则至少需要含90%碳酸钙的石灰石多少千克才能将其完全吸收(写出解题过程,计算结果保留一位小数)_______?
2CaSO4+2CO2。若1000kg废气中含有1.6kg的二氧化硫,则至少需要含90%碳酸钙的石灰石多少千克才能将其完全吸收(写出解题过程,计算结果保留一位小数)_______?
【答案】长颈漏斗 锥形瓶 A b 氢气密度比空气小可采用Ⅱ装置收集 CaCO3+2HCl=CaCl2+H2O+CO2↑ 石蕊试液 2.8kg
【解析】
(1)根据常见的仪器分析;
(2)根据药品的状态和反应的条件分析;
(3)根据装置的特点分析;
(4)根据二氧化硫的质量结合化学方程式进行计算。
(1)长颈漏斗便于液体药品的加入,锥形瓶是常用的反应容器,a是长颈漏斗;b是锥形瓶;
(2)实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),因此需要加热;故选A发生装置;
(3)①当打开K1、关闭K2时,利用Ⅰ和Ⅱ装置,可进行的实验是:锌与稀硫酸反应制取氢气,因为氢气密度比空气小可采用Ⅱ装置收集或Ⅱ装置中进气管短;
②碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;二氧化碳能与水发生反应生成碳酸,溶液显酸性,应向烧杯的水中加入石蕊试液来验证;
(4)解:设至少需要含90%碳酸钙的石灰石的质量为x

![]()
x≈2.8kg
答:至少需要含90%碳酸钙的石灰石2.8kg才能将其中的二氧化硫完全吸收。

 阅读快车系列答案
阅读快车系列答案