题目内容
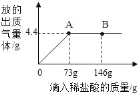
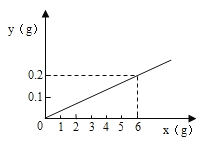
【题目】用某金属颗粒与足量的稀盐酸反应,如生成氢气的质量(以纵坐标表示,单位:g)与所用金属的质量(以横坐标表示,单位:g)之间的关系如图,该金属颗粒可能是:
A. 纯净的锌
B. 含铜的锌
C. 含有不与酸反应的杂质的铁
D. 含有不与酸反应的杂质的锌
【答案】C
【解析】
试题金属与酸反应的条件:在金属活动性顺序表里排在氢前面的金属能置换酸中的氢(除去活动性太强的K、Ca、Na),铜排在氢的后面,所以不会跟酸反应,根据生成氢气的质量(以纵坐标表示,单位:g)与所用金属的质量(以横坐标表示,单位:g)之间的关系图,可知当生成氢气0.2g时,消耗的金属质量为6g,A、纯净的锌:Zn+2HCl=ZnCl2+H2↑,根据锌与氢气的质量关系65:2=x:0.2,要生成0.2g氢气,需要锌的质量应该为6.5g,故错误,B、要生成0.2g氢气需要纯净的锌6.5g,若含有不与酸反应的铜,那6g金属就更不可能生成0.2g氢气了,错误,C、铁与酸反应:Fe+2HCl=FeCl2+H2↑,根据铁与氢气的质量关系56:2=x:0.2,要生成0.2g氢气,只需要铁的质量应该为5.6g,故可以含有0.4g不与酸反应的杂质,正确,D、根据锌与氢气的质量关系65:2=x:0.2,要生成0.2g氢气,需要锌的质量应该为6.5g,本身质量就不够,所以不可能含有其他的杂质,不正确,故选C

练习册系列答案
相关题目