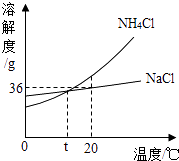
题目内容
【题目】甲、乙、丙三位同学在活动课上探究气体的制备。利用下图所示装置制取常见的气体,并对它们的有关性质进行研究,请根据题意回答下列问题。
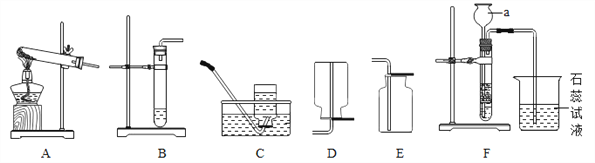
(1)实验仪器a的名称是_____________
(2)甲同学用KMnO4固体制取O2,发生装置应选用上图中的___________装置(填编号),该反应的化学方程式为_____________________。
(3)乙同学用浓盐酸与大理石在F装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红,对这一现象解释不合理的是_________(填序号)
a.产生的CO2直接使石蕊变红
b.产生的CO2与H2O反应生成H2CO3,使石蕊试液变红
c.挥发出的氯化氢溶于水,使石蕊试液变红
(4)丙同学在实验室氯化铵固体与碱石灰固体共热来制取氨气(NH3)。常温下NH3是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。
①制取氨气反应的化学方程式 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑+ 2X。X的化学式为:_________________________。
②制取并收集NH3,应该从上图中选择的收集装置是________。
【答案】 长颈漏斗 A 2KMnO4![]() K2MnO4+MnO2+O2↑ a H2O D
K2MnO4+MnO2+O2↑ a H2O D
【解析】(1)由图可知,a是长颈漏斗;(2)根据反应物的状态和反应条件选择发生装置,用加热高锰酸钾的方法制取氧气属固固加热型,故发生装置选A;加热高锰酸钾分解制取氧气的同时,还生成了锰酸钾和二氧化锰,故反应的化学方程式是2KMnO4 △K2MnO4 +MnO2 + O2↑;(3)二氧化碳不能使紫色的石蕊试液变成红色,紫色石蕊试液变红的原因是二氧化碳与水反应生成碳酸,碳酸使紫色石蕊试液变成红色,另外盐酸具有挥发性,能挥发出氯化氢气体,氯化氢气体溶于水形成盐酸,盐酸也能使紫色的石蕊试液变成红色,故选a;(4)①根据质量守恒定律化学反应前后原子的种类和数目不变,反应前N:2,H:,10,Cl:2,Ca:1,O:2,反应后N:2,H:6,Cl:2,Ca:1,O:0,X前有化学计量数2,故X的化学式表示为H2O;②氨气密度比空气小,极易溶于水,故只能用向下排空气法收集,故选D装置。