题目内容
在化学课上,甲同学将燃烧的钠(Na)迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.老师告诉同学们,这种黑色颗粒和白色物质都是化学实验室中的常用药品之一。
【提出问题】黑色颗粒和白色物质分别是什么?
【进行猜想】甲认为黑色颗粒是 炭(C),白色物质可能是碳酸钠( Na2CO3)或氧化钠(Na2O),乙同学还认为白色物质是氢氧化钠(NaOH).经过分析甲同学认为乙同学的猜想是错误的,其理由是_______________________,
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠,氢氧化钠与盐酸反应生成氯化钠和水。碳酸钠也是白色粉末,与盐酸反应会产生二氧化碳、水、氯化钠。
【实验探究】甲同学对黑色颗粒,白色物质分别是什么物质进行实验探究.
| 实验步骤 | 实验操作 | 实验现象 | 结论 |
| 步骤1 | 在氧气流中充分燃烧黑色固体,并把产生的气体通入澄清石灰水中 | 黑色固体完全消失,澄清石灰水变浑浊 | 黑色固体是____________ |
| 步骤2 | 取少量白色固体于试管中,加入适量水,振荡,样品全部溶于水,向其中加入盐酸 | 产生气泡 | 白色固体是___________ |
【拓展反思】通过这个实验,你对燃烧条件有什么新的认识?_______________________________________________
反应物中没有氢元素,所以产物中也就不会出现氢元素.(或不符合质量守恒定律等合理答案) 炭(或C) 碳酸钠(或Na2CO3)
燃烧不一定要氧气参加(或二氧化碳可作为某些物质燃烧的助燃剂、或某些物质的燃烧可作为助燃剂的不仅仅是氧气等合理答案)
解析试题分析:依据质量守恒定律,化学反应前后元素的种类不变,反应物中没有氢元素,所以产物中也就不会出现氢元素;根据现象澄清石灰水变浑浊说明黑色物质燃烧生成了二氧化碳,故黑色固体是炭;加稀盐酸生成了气体,根据资料,则白色固体是碳酸钠;钠能在二氧化碳中燃烧,说明燃烧不一定要氧气参加。
考点:实验探究

化学小组同学在课外读物中看到:“通常CO2可作灭火剂,但有些物质(如Na)着火,不能用CO2熄灭” 。他们决定探究CO2与Na反应的产物。
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3。
【查阅资料】
①Na是非常活泼的金属,常温下与O2、H2O等物质反应。
②碱性的Na2CO3溶液与中性的CuCl2溶液发生复分解反应。
③Na2O是白色固体,与H2O反应生成NaOH。
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。
【实验过程】同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)
(1)实验记录
| 序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| ① | 打开a,关闭b,由长颈漏斗注入稀盐酸 | A中产生大量气泡 E中出现浑浊 | E中反应的化学方程式为_____________ |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体 G中产生黑色沉淀 | 反应产物一定有_______和_______ |
| ③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有________ |
(2)实验反思
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的是___________。
②若无装置C,对实验有影响的物质是__________。
③检验第4种物质是否存在的实验方案:取D中白色固体于试管中,
。
某化学兴趣小组对一包干燥的红色粉末组成进行探究。请你参与并回答问题。
【教师提醒】它由Cu 、Fe2O3两种固体中的一种或两种组成。
【提出猜想】红色粉末可能的组成,
猜想①:只有Cu;猜想②:只有 ;猜想③:是Cu 、Fe2O3的混合物
【实验探究】
同学们为确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右下图在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,继续通CO气体直至玻璃管冷却。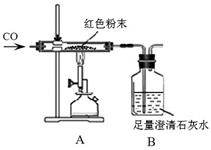
(1)在装置A中先通CO气体的目的是 。A装置中发生反应的化学方程式 ;实验中观察到A装置中的现象为 。
(2)反应前后称量相关装置和物质的总质量,其数据如下表:
| 反应前 | 反应后 |
| 玻璃管和红色粉末的总质量为37.3 g | 玻璃管和固体物质的总质量为36.1 g |
小蒋同学初步分析表中的数据后,马上得出猜想 (填“①”“②”“③”)肯定不正确,理由是 。
(3)小林同学认为为了防止溶液倒吸,本实验停止加热前应 先断开A和B的连接,你认为是否需要? (填“需要”或“不需要”),理由是 。
【反思评价】实验后小组内有同学指出:上图装置未进行尾气的处理。于是有同学设计了用右图装置代替原装置,则C装置的作用有 、 (至少答两点)。

某兴趣小组同学阅读课外资料得知:很多因素都能影响过氧化氢分解速度。于是,
同学们探究影响过氧化氢分解速度的某种因素。
【实验过程】实验数据记录如下:
| | 过氧化氢溶液的质量 | 过氧化氢溶液的浓度 | MnO2的质量 | 测量数据 |
| Ⅰ | 50.0g | 1% | 0.1g | 9 mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16 mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31 mL |
【实验分析】
(1)过氧化氢分解的化学方程式为 。
(2)表格中的“测量数据”的指的是:相同时间内 _。
(3)本实验中,测量O2体积的装置是 (填编号)。

【实验结论】
在相同条件下 。
【交流评价】
(1)甲同学提出在上述实验中测量 同样能得出相同的结论。
(2)乙同学提出用下图装置进行实验,通过比较 也能达到实验目的。

【实验反思】
除了上述因素会影响过氧化氢分解速度外, _(写一种)也会影响过氧化氢分解速度,你的实验方案是 。
某化学兴趣小组根据下列转化关系在实验室中模拟炼铁,并对产物成分进行探究。
(1)炼铁的原理是 (用化学方程式表示)。
(2)经初步分析得知,无色气体A不含有单质,黑色粉末B的成分是一种或两种单质。上述转化关系中,生成一氧化碳的化学方程式是 。
(3)甲、乙两个兴趣小组分别对无色气体A和黑色粉末B的成分进行探究。
【猜想与假设】
甲组在分析了炼铁的原理后,认为无色气体A中可能有CO2,也可能有未反应的 。
乙组认为黑色粉末的成分中存在以下两种情况:
假设一:只含有铁。假设二:含有 。
【实验探究】
为验证甲组的猜想,同学们按下图所示装置进行实验(箭头表示气体流向)。
Ⅰ澄清石灰水 Ⅱ浓硫酸 Ⅲ氧化铜粉末
上述实验装置Ⅱ中浓硫酸的作用是吸收水蒸气,装置Ⅰ的作用是 ,装置Ⅲ的作用是 。当看到Ⅰ中澄清石灰水变浑浊,Ⅲ中黑色固体变成红色后,可以确定无色气体A的成分是 。
为验证乙组中假设二是否成立,请你设计实验用物理和化学两种方法完成以下探究。
| 实验方法 | 实验操作 | 实验现象 | 实验结论 |
| 物理方法 | | | 假设二成立 |
| 化学方法 | | | 假设二成立 |
【交流反思】针对甲组实验存在的缺陷,同学们一起进行了改进,解决了污染环境问题。
某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示液,他们对此产生了兴趣。
[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种。为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是 。
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是 。
为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验。
[设计实验]
| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸 | 先出现白色沉淀,后产生大量气泡 |
[实验结论]该瓶无色溶液是 。
生成白色沉淀过程的化学方程式是 。
[实验反思]小强认为上述设计实验还可简化,仍能达到目的。小强的实验操作是 。经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐,简述实验操作和现象 。



