题目内容
【题目】人类生活生产离不开金属,不仅因为其物理性能优良,还与化学性质密切相关。
(1)铝、铁、铜是我们生产生活中使用比较广泛的金属。下列用品中,利用金属导热性的是__(填序号,下同),延展性的是__。
A 不锈钢锅B 铜导线C 铝箔
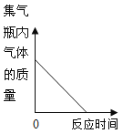
(2)某小组用图所示装置对铁生锈的条件进行探究。
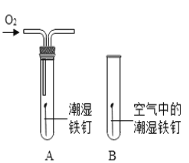
4min后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是_____;
(3)工业生产常用10%的稀盐酸来除铁锈,写出除锈的化学反应方程式________;实验室用浓盐酸配制10%稀盐酸时,用到的主要仪器有___________________;
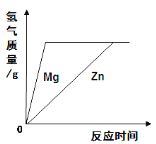
(4)在金属活动顺序表中,金属位置越靠前,越容易失去电子。Ca、Mg、K三种金属失去电子能力由强到弱的顺序是_____,如图是三种原子的结构示意图:
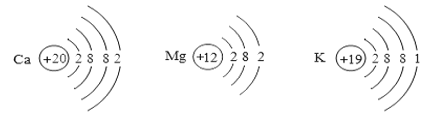
据此推测金属失去电子能力的强弱除与最外层电子数有关外,还可能与_____有关。
(5)某兴趣小组在实验室中模拟炼铁的原理,如下图所示:
①实验中玻璃管里氧化铁粉末的颜色变化是________,发生反应的化学方程式是__________
②实验前“通入CO”与“开始加热”的顺序是;实验后“停止通入CO”与“停止加热”的顺序是__________。
③实验要在装置末端a处燃着一盏酒精灯,如下图:
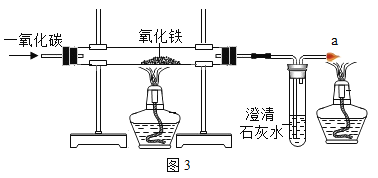
其作用是______________。
【答案】A C 氧气的浓度 Fe2O3+6HCl=2FeCl3+3H2O 量筒、烧杯、玻璃棒、胶头滴管 K、Ca、Mg 电子层数 红色粉末变黑色 3CO+Fe2O3![]() 2Fe+3CO2 先停止加热后停止通入CO 点燃尾气,为了防止一氧化碳对大气的污染
2Fe+3CO2 先停止加热后停止通入CO 点燃尾气,为了防止一氧化碳对大气的污染
【解析】
解:(1)铝、铁、铜是我们生产生活中使用比较广泛的金属。不锈钢锅是利用金属的导热性,铝箔是利用金属的延展性;
(2)铁生绣的条件是铁与氧气、水共同作用的结果,对比A、B两图,就是空气与氧气中氧气的浓度不同;
(3)铁锈的主要成分是氧化铁,它能与稀盐酸反应生成氯化铁和水,化学反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O;配制溶液所需要的仪器主要有量筒、烧杯、玻璃棒、胶头滴管;
(4)根据所学的金属活动性顺序和题目的已知条件“在金属活动顺序表中,金属位置越靠前,越容易失去电子”,可知Ca、Mg、K三种金属失去电子能力由强到弱的顺序是K、Ca、Mg;据图中信息可知,金属失去电子能力的强弱除与最外层电子数有关外,还可能与电子层数有关;根据题目所给的原子结构示意图,发现Mg比K、Ca少一个电子层;
(5)①由于在高温下,一氧化碳将氧化铁还原为铁,同时生成了二氧化碳;所以实验中玻璃管里氧化铁粉末的颜色变化是红色粉末变黑色;生成的二氧化碳能能使澄清石灰水变浑浊;一氧化碳与氧化铁在高温条件下生成铁和二氧化碳,反应的化学方程式是:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
②由于玻璃管内有空气,通入一氧化碳高温时易发生爆炸。所以实验前先通入CO,排净玻璃管中的空气再开始加热,实验后为防止生成的铁被空气中的氧气氧化,所以实验后先停止加热,后停止通入CO;
③为了防止一氧化碳对大气的污染,所以,实验时要在装置末端a处燃着一盏酒精灯除去反应剩余的CO。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表所示。根据表中信息判断下列说法正确的是
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量 | 2 | 30 | 20 | 10 |
反应后的质量 | m | 39 | 5 | 16 |
A.该反应是化合反应B.甲一定是该反应的催化剂
C.反应过程中乙、丙变化的质量比为3:5D.丙可能是单质