题目内容
课本“分解过氧化氢制氧气的反应中二氧化锰的催化作用”以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
实验步骤 实验现象
Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 A试管中产生气泡,带火星木条复燃,B试管中无明显现象
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 试管中均产生气泡,带火星木条均复燃
Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。
【实验结论】
(1)A中产生的气体是 。
(2)实验Ⅱ、Ⅲ证明:氧化铁的 和 在反应前后均没有发生变化,可以作过氧化氢溶液分解的催化剂。
(3)写出氧化铁催化过氧化氢溶液分解的符号表达式 。
【实验评价】
(1)实验设计Ⅳ的目的是 。
(2)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。
【实验拓展】
(1)查阅资料得知:CuO、CuSO4、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是 (填序号)。
A.MnO2只能作过氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂只能加快化学反应的速率
D.用作催化剂的物质不可能是其他反应的反应物或生成物
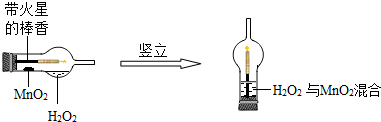
(2)实验创新是中学生最为重要的科学素养。下图是某学校的师生对“MnO2催化H2O2溶液分解实验装置的创新设计”,实验过程如下:
①将一支球形干燥管水平放置,用滴管吸取3ml(密度为1g/ml)质量分数为5%的H2O2加入干燥管的球泡内,再用药匙取0.2gMnO2粉末,加在干燥管的进气管的管壁上。
②点燃橡胶塞上棒香后,塞紧干燥管并将其竖立,观察到带火星的棒香立即复燃。

对该创新实验的评价,你认为不合理的是 (填序号)。
A.实验中所用的仪器、材料及药品均易得到
B.实验使用的药品用量太大
C.反应速度太慢,耽误时间
D.实验现象明显,整个装置好似点燃的灯塔,趣味性强
【实验结论】
(1)O2。(2)质量和化学性质
(3)略
【实验评价】
(1)比较氧化铁与二氧化锰的催化效果
(2)二氧化锰的催化效果比氧化铁好
【实验拓展】
(1)B。(2)B、C
【解析】
试题分析:(1)A中产生的气体能使带火星木条复燃,说明是氧气;
(2)判断一种物质是否是某反应的催化剂,要看它是否具备催化剂的特征,即“一变二不变”:能否改变反应的速率;反应前后本身的质量,是否改变;本身的化学性质是否改变。通过Ⅱ、Ⅲ可知氧化铁的质量和化学性质在反应前后均没有发生变化,可以作过氧化氢溶液分解的催化剂。
(3)H2O2------H2 O+O2
【实验评价】两支试管都是量取5mL5%过氧化氢溶液,但加入的催化剂不同,所以是比较氧化铁与二氧化锰的催化效果;实验Ⅳ观察到D试管中产生气泡的速率更快,说明二氧化锰的催化效果比氧化铁好。
【实验拓展】(1)只有具备“一变二不变” 的特征,那它就的该反应的催化剂。其中“一变”指的是改变物质反应的速率,“改变”包括加快和减慢两个方面;催化剂可能是其他反应的反应物或生成物,如二氧化锰,同一个化学反应可以有多种催化剂如该实验,但很多物质不是特定的催化剂,如二氧化锰可以是催化剂也可以是高锰酸钾分解的生成物。
(2)只需要3ml(密度为1g/ml)质量分数为5%的H2O2 ,药品用量很少,B错误;点燃橡胶塞上棒香后,塞紧干燥管并将其竖立,观察到带火星的棒香立即复燃,说明反应速度很快,C错误;
考点:催化剂的性质

 金博士一点全通系列答案
金博士一点全通系列答案(1)甲同学将课本的基础知识进行整理如下图,请你帮助他完成相关内容.
| 制取[发生与收集]气体 | 所需药品 | 装置连接顺序 | 反应的化学方程式 |
| 氧气 | 高锰酸钾 | ||
| 二氧化碳 | 大理石和稀盐酸 |
①要回收产物中的二氧化锰要进行的操作顺序是
a.烘干 b.溶解 c.过滤 d.洗涤
②过滤、蒸发都需用到的玻璃仪器是
A.酒精灯 B.烧杯 C.玻璃棒 D.漏斗
(3)分解过氧化氢溶液也可制得氧气,反应方程式是
某校化学研究性学习小组探究气体制取的实验原理与方法.
(1)甲同学将课本的基础知识进行整理如下图,请你帮助他完成相关内容.

| 制取[发生与收集]气体 | 所需药品 | 装置连接顺序 | 反应的化学方程式 |
| 氧气 | 高锰酸钾 | ______ | ______ |
| 二氧化碳 | 大理石和稀盐酸 | ______ | ______ |
①要回收产物中的二氧化锰要进行的操作顺序是______(填写选项序号).
a.烘干 b.溶解 c.过滤 d.洗涤
②过滤、蒸发都需用到的玻璃仪器是______(填序号).
A.酒精灯 B.烧杯 C.玻璃棒 D.漏斗
(3)分解过氧化氢溶液也可制得氧气,反应方程式是______,其中二氧化锰起______作用.34g过氧化氢中氧元素的质量m1=______g,34g过氧化氢完全分解后,放出氧气的质量m2=______g.根据质量守恒定律,(m1-m2)能表示什么的质量?______.
课本“分解过氧化氢制氧气的反应中二氧化锰的催化作用”以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【提出问题】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
【实验探究】
| 实验步骤 | 实验现象 |
| I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
| II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
| III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
|
| IV.分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
|
【实验结论】
(1)A中产生的气体是 。
(2)实验II、III证明:氧化铁的 和 在反应前后均没有发生变化,可以作过氧化氢溶液分解的催化剂。
(3)写出氧化铁催化过氧化氢溶液分解的符号表达式 。
【实验评价】
(1)实验设计IV的目的是 。
(2)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 。
【实验拓展】
(1)查阅资料得知:CuO、CuSO4、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是 (填序号)。
A.MnO2只能作过氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂只能加快化学反应的速率
D.用作催化剂的物质 不可能是其他反应的反应物或生成物
不可能是其他反应的反应物或生成物
(2)实验创新是中学生最为重要的科学素养。下图是某学校的师生对“MnO2催化H2O2溶液分解实验装置的创新设计”,实验过程如下:
①将一支球形干燥管水平放置,用滴管吸取3ml(密度为1g/ml)质量分数为5%的H2O2加入干燥管的球泡内,再用药匙取0.2gMnO2粉末,加在干燥管的进气管的管壁上。
②点燃橡胶塞上棒香后,塞紧干燥管并将其竖立,观察到带火星的棒香立即复燃。
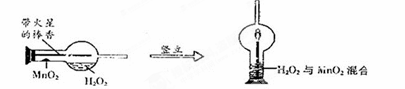
对该创新实验的评价,你认为不合理的是 (填序号)。
A.实验中所用的仪器、材料及药品均易得到
B.实验使用的药品用量太大
C.反应速度太慢,耽误时间
D.实验现象明显,整个装置好似点燃的灯塔,趣味性强