题目内容
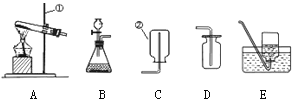
【题目】南京著名的风景点——珍珠泉,水底有大量的气泡冒出,像一串串珍珠,珍珠泉由此得名。某学生推测这种气体可能是沼气,查资料得知,沼气中含60%~70%的CH4,还含有CO2、N2和CO等。他想用实验检验珍珠泉冒出气体的组成,设计了如图甲所示的取气方法:

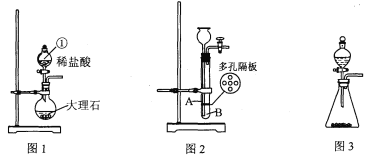
将空的雪碧汽水塑料瓶装满水,倒放在泉水中,瓶口对准水底冒出的气泡进行收集。
⑴这种集气方法叫 ,针对瓶口太小不便收集的缺点,在不换瓶的情况下,你改进的方法是 。
⑵如图乙所示,若用水将瓶中的气体排出,水龙头应接导管___________(填A或B)。
⑶假设将这种未知气体通过澄清石灰水,石灰水变浑浊,剩余气体通过浓硫酸(以上两步,能被吸收的气体均被完全吸收),再通入纯氧气中点燃,将燃烧后生成的气体依次通过无水硫酸铜(检验水)、澄清石灰水,观察到无水硫酸铜变蓝,石灰水变浑浊。仅由以上实验现象分析此未知气体的组成,结论是 。
【答案】(1)排水集气法 在气泡上方罩一个漏斗 (2)A (3)一定有二氧化碳和甲烷,可能有氮气和一氧化碳
【解析】
试题分析:(1)收集气体的方法为向上排空气法、向下排空气法、排水集气法三种方法,显然这种方法为排水集气法,针对瓶口太小不便收集的缺点,故只能扩大瓶口,故改进的办法为在瓶口加一个漏斗;(2)因为气体的密度比水的小,加入水后气体上浮,故水龙头应该接A;(3)根据题中的叙述,将这种未知气体通过澄清石灰水,石灰水变浑浊说明一定含有二氧化碳;剩余气体通过浓硫酸(以上两步,能被吸收的气体均被完全吸收),再通入纯氧气中点燃,将燃烧后生成的气体依次通过无水硫酸铜(检验水)说明有水生成,一定有含有氢元素的甲烷,、澄清石灰水,观察到无水硫酸铜变蓝,石灰水变浑浊,说明有水和二氧化碳生成,一定有含有氢元素的甲烷;氮气和一氧化碳没有进一步的验证,故可能含有。

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.
【提出问题】①氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计并完成实验】
Ⅰ.将3.0g氯酸钾放在试管中加热
Ⅱ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ.将x g氯酸钾与1.0g氯化铜均匀混合加热
【实验现象分析】
Ⅲ中x的值应为 ,将实验Ⅰ和Ⅲ比较可证明 ,将实验Ⅲ反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到1.0g黑色粉末,再将黑色粉末和xg氯酸钾混合加热,现象与实验Ⅲ相同,此步骤是为了证明氧化铜在该化学反应前后 和 都不变.
【结论】氧化铜还能作氯酸钾分解的催化剂,请写出实验Ⅲ中的化学反应文字表达式
【实验反思】实验Ⅱ和Ⅲ对比是为了证明
【提出问题】②双氧水分解速度还和什么因素有关
【设计并完成实验】
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
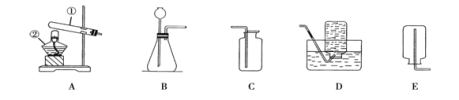
本实验中,测量O2体积的装置是 (填编号)
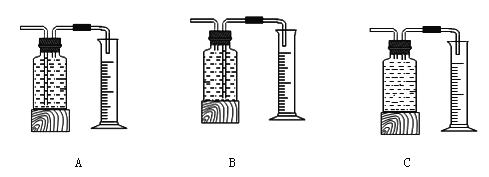
【结论】在相同条件下,双氧水的浓度越大,双氧水分解得越 。