题目内容
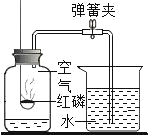
【题目】某同学设计了测定空气中氧气含量的实验,实验装置如图。该同学的实验步 骤如下:
①将图中的集气瓶分为 5 等份,并作好标记。
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒 精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞。
③充分反应后,待集气瓶冷却至室温,打开止水夹。 请回答下列问题:
(1)该实验中红磷需稍过量,目的是_____。
(2)步骤②集气瓶中的现象是_____;步骤③中打开止水夹后观察到的现象 是_____,由此可得出空气中氧气的体积分数约为_____。
(3)该实验可推论出氮气_____(填“ 易” 或“ 难” )溶于水和其化学性质_____(填“活泼”或“不活泼”)的结论。
(4)若将红磷换成炭粉,该实验能否获得成功?为什么?_____成功,原因是_____。

【答案】充分反应掉集气瓶中的氧气 。红磷燃烧发出黄光,产生热量,生成了大量的 白烟 ;水沿导管被吸入集气瓶中,大 约占瓶内容积的五分之一 ,20% 。难不活 泼不能因为碳燃烧产生气体,使瓶中大气压不变 。
【解析】
(1)红磷过量,可使集气瓶中的氧气完全消耗,减少误差;
(2)由于红磷消耗了空气中的氧气使集气瓶内的压强减小,打开止水夹后观察到:水沿导管倒流进入集气瓶中,倒流至集气瓶容积的五分之一;
(3)在该实验中,剩余的气体主要是氮气,说明氮气不溶于水,氮气不能燃烧,也不能支持燃烧,化学性质不活泼;
(4)木炭和氧气反应又生成二氧化碳,没有改变集气瓶内的压强。

【题目】某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:
(设计并实验)
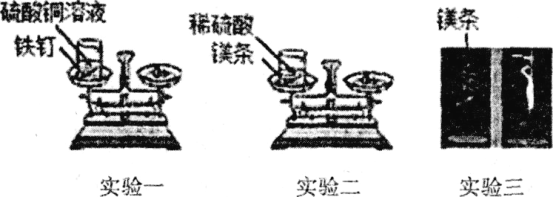
(实验一)将盛有硫酸铜溶液的烧杯和铁钉一起放在托盘天平上称量,记录所称的质量。然后将铁钉浸到硫酸铜溶液中,观察现象。待反应一段时间后溶液颜色改变时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
(实验二)将盛有稀硫酸的烧杯和镁条一起放在托盘天平上称量,然后将镁条浸到稀硫酸中,观察现象。待反应一段时间后不再放出气泡时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
(实验三)用天平称量一段砂纸打磨过的镁条的质量并进行记录,然后将该镁条在空气中点燃,待反应结束后,将生成物全部收回,再次进行称量并记录。
上述三个实验所记录的数据见下表。
编号 | 实验一 | 实验二 | 实验三 |
反应前/g | 118.4 | 112.6 | m1 |
反应后/g | 118.4 | 112.4 | m2 |
(分析与讨论)
(1)在这三个实验中,你认为实验________正确反映了反应物与生成物之间的质量关系,由此得出的结论是:在化学反应中生成物的总质量与反应物的总质量相等,请从原子的角度分析结论正确的理由是________。
(2)上述表格中m1和m2的关系是:m1________m2(填>、=或<)
(3)从实验二中得出的结论是:在化学反应中生成物的总质量与反应物的总质量不相等,你认为导致这一结论错误的原因是________.
(实验反思)小组成员从不能正确反映反应物和生成物之间质量关系的实验中,找出了实验设计中的不当之处,并达成了以下共识:设计实验验证质量守恒定律时,对于有空气中的气体(成分)参与或有气体生成的化学反应,一般应使反应在________中进行。
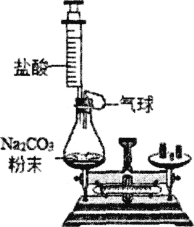
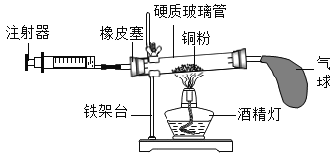
(实验拓展)小明同学从安全的角度考虑,将实验二的装置进行了改进,如图所示.
(1)按如图方式放好仪器,调节天平平衡,记录称量数据.
(2)小明缓慢推动注射器,将稀盐酸加到碳酸钠粉末上,此时察到碳酸钠粉末的表面上有________出现。
(3)此实验中气球的主要作用是________.
(4)当反应结束时,气球已经完全鼓起,小明发现天平的指针已经向右偏了。他感到困惑:其他操作均正常,实验现象与数据为何与预测结果不符?你认为出现该实验现象的合理解释最应该是下列各项中的________(填序号).
A.该反应前后原子的种类、数目变少
B.该反应生成物的总质量小于反应物的总质量
C.空气的浮力作用干扰了实验结果
D.生成气体的反应不遵守质量守恒定律.