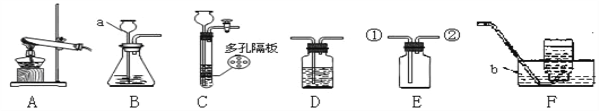
题目内容
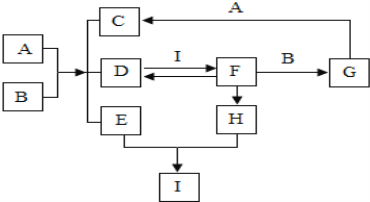
【题目】图中表示的是几种常见物质的转化关系(部分反应条件、反应物、生成物省略)。已知C为生活中不可缺少的调味品,D是一种常见气体,F为大理石的主要成分,请回答以下问题:
(1)写出E的化学式_____ ;
(2)写出A和B反应的化学方程式_______________,属于____反应基本类型;
(3)写出D和I的溶液反应的现象_________________;
(4)写出I的一种用途__________。
【答案】 H2O Na2CO3+2HCl=2NaCl+H2O+CO2↑ 复分解 出现白色沉淀 制作农药波尔多液
【解析】C为生活中不可缺少的调味品,故C是氯化钠;F为某种建筑材料的主要成分,可以是碳酸钙;D能和F相互转化;故D可能是二氧化碳;I能和D反应生成碳酸钙,故I可能是氢氧化钙;A和B能反应生成三种物质,且生成了二氧化碳,故A和B的反应可能是碳酸盐和酸的反应;碳酸钙能与B反应,故B可能是盐酸,A可能是碳酸钠;碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,G能与碳酸钠反应,故G可能是氯化钙,生成的C是氯化钠;故E是水;碳酸钙高温能分解生成氧化钙,氧化钙能与水反应生成氢氧化钙,带入框图,推断合理;
(1)E是水,化学式为:H2O;
(2)B和A的反应是盐酸和碳酸钠反应生成水、二氧化碳和氯化钠,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,反应类型为复分解反应;
(3)D是二氧化碳,I是氢氧化钙,二氧化碳与氢氧化钙反应生成白不溶于水的碳酸钙沉淀,使溶液变浑浊;
(4)通过推导可知,I是氢氧化钙,具有碱性,可以用于改良酸性土壤或制作农药波尔多液。

 目标测试系列答案
目标测试系列答案【题目】等差量的铁粉与过量的盐酸在不同的实验条件下进行反应,测定在相同时间t产生气体体积V的数据,根据数据绘制得到图1。
组别 | 盐酸的溶质质量分数 | 温度(℃) |
1 | 7 | 30 |
2 | 10 | 50 |
3 | 7 | 20 |
4 | 10 | 30 |

(1)请写出铁粉稀盐酸反应的化学方程式__________________________。
(2)由实验_________(填组别)可知,温度对于金属与酸反应速率的影响是_____。
(3)图1中表示第3组实验的曲线是____________。
[进一步探究]图甲、图乙为利用数字化仪器测得的室温下足量的三种金属片分别与200ml100℅的稀盐酸反应产生氢气的量。(产生氢气的量由气体压强表示,在等温条件下,产生氢气体积与装置内压强成正比)。

①实验中你认为,还要控制的变量是_________________________。
②由图乙,你得出的反应物的量与生成的气体体积的关系是____________。
[拓展提高]下图为测得的室温下足量的镁片与20ml110℅的稀盐酸反应产生氢气的量与时间关系曲线,发现实验测得的实际值比通过计算得到的理论值偏大,请分析可能的原因(至少答两点)。

①_______________________________。
②________________________________________。