题目内容
【题目】(8分)氢氧化钠与盐酸的反应无明显现象,某化学兴趣小组为证明氢氧化钠与盐酸发生了化学反应,进行了如下的实验探究。
【实验探究一】小云在试管中加入约2mL稀氢氧化钠溶液,滴入2滴酚酞溶液,振荡,溶液变为红色。然后向该试管中滴加稀盐酸,观察到溶液 ,证明氢氧化钠与盐酸发生了反应,该反应的化学方程式为 。
【反思评价】 小霞提出也可以使用石蕊试液代替无色酚酞进行上述实验。你认为 (填“无色酚酞”或“石蕊试液”)更适合用于验证二者恰好完全反应,你的理由是 。
【实验探究二】小兰同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
编号 | 盐酸 | NaOH溶液 | △t/℃ |
1 | 3.65﹪ | 2.00﹪ | 3.5 |
2 | 3.65﹪ | 4.00﹪ | x |
3 | 7.30﹪ | 8.00﹪ | 14 |
表中x = 。
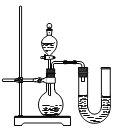
【反思评价】某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。但有同学认为单凭此现象不足以说明该反应放热,其理由是 。
【拓展延伸】不是所有的碱与盐酸反应都无明显现象,例如 (填一种碱)与盐酸反应就有明显的实验现象。
【答案】【实验探究一】 红色逐渐消失 NaOH+HCl==NaCl+H2O
【反思评价】 无色酚酞 由红色变为无色,颜色变化比较明显
【实验探究二】 7
【反思评价】 U型管液面左低右高 从分液漏斗中滴入的液体也会占一部分体积
【拓展延伸】 Cu(OH)2
【解析】
试题分析:【实验探究一】无色酚酞遇碱溶液变红,但随着滴加稀盐酸,把NaOH反应掉了,所以可以观察到溶液红色逐渐消失,反应的化学方程式为:NaOH+HCl==NaCl+H2O
【反思评价】可以使用石蕊试液代替无色酚酞进行上述实验,但用无色酚酞更合适,原因是:由红色变为无色,颜色变化比较明显
【实验探究二】根据表中每次混合前后温度的升高值△t,可以判断表中x =7
【反思评价】根据中和反应放热,使装置内的空气受热膨胀,压强增大,所以导致U型管液面左低右高,从而判断NaOH溶液与稀盐酸发生了中和反应,但有同学认为单凭此现象不足以说明该反应放热,其理由是:从分液漏斗中滴入的液体也会占一部分体积,同样会使U型管液面出现左低右高
【拓展延伸】不是所有的碱与盐酸反应都无明显现象,像Cu(OH)2等,发生反应:Cu(OH)2+2HCl==CuCl2+2H2O,现象是:不溶物溶解,溶液变为蓝色

【题目】(7分)水和溶液在生产、生活中起着十分重要的作用。
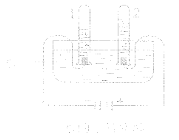
(1)下图是电解水实验装置。在实验过程中,试管1产生的气体是 ,写出水在通电条件下反应的化学方程式 。
(2)将源水处理成自来水的过程中需加入生石灰,生石灰与水反应的化学方程式为__ __。
(3)20℃时,氯化钠的溶解度为36g,则20℃时氯化钠饱和溶液中溶质和溶剂的质量比为 。
(4)为了进行农业选种,现将200g30%的氯化钠溶液稀释为10%的氯化钠溶液,需要加水的质量为 。
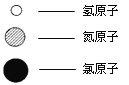
(5)自来水中通入少量氯气可以杀菌消毒,化工厂常用浓氨水检测氯气储存设备或者输气管是否有氯气泄漏。A、B、C、D表示4种物质,其微观示意图见下表,A和B在一定条件下反应生成C和D。
物质 | A | B | C | D |
|
化学式 | NH3 | Cl2 | N2 | ||
微观示意图 |
|
|
|
|
D的化学式为 。
若17 g A参加反应,则生成C的质量为 g。