题目内容
已知CuSO4溶液显蓝色,该溶液中含有较多的Cu2+和SO42-离子.
(1)提出问题:溶液的颜色是由什么离子引起的?
现有试剂:K2SO4溶液、NaOH溶液、BaC12溶液、锌粉;
现有仪器:试管、烧杯、铁架台(带铁圈)、漏斗、滤纸、玻璃棒.
(2)假设:溶液的蓝色的是由Cu2+引起的,而不是由SO42-引起的.
(3)验证:
(1)提出问题:溶液的颜色是由什么离子引起的?
现有试剂:K2SO4溶液、NaOH溶液、BaC12溶液、锌粉;
现有仪器:试管、烧杯、铁架台(带铁圈)、漏斗、滤纸、玻璃棒.
(2)假设:溶液的蓝色的是由Cu2+引起的,而不是由SO42-引起的.
(3)验证:
| 操作步骤 | 现 象 | 结 论 |
| ______ | ______ | ______ |
硫酸铜溶液的蓝色可能是铜离子引起的,也可能是硫酸根离子引起的,也可能是水分子引起的;
通过观察硫酸钾溶液可以确定水分子、硫酸根离子能否使溶液显蓝色;
硫酸铜能和氢氧化钠反应生成蓝色沉淀氢氧化铜和硫酸钠,当硫酸铜完全反应时,溶液由蓝色变成无色,生成的硫酸钠溶液是无色的,可以说明硫酸根离子是无色的,同时说明溶液的蓝色的是由Cu2+引起的.
验证如下:
①步骤:取适量硫酸钾溶液于试管中,观察溶液的颜色;现象:溶液是无色的;结论:溶液的蓝色不是水分子、硫酸根离子引起的;
②步骤:向硫酸铜溶液中滴加氢氧化钠溶液;现象:溶液的蓝色逐渐变浅直至消失;结论:硫酸铜溶液的颜色是由铜离子引起的.
故填:①取适量硫酸钾溶液于试管中,观察溶液的颜色;②向硫酸铜溶液中滴加氢氧化钠溶液.①溶液是无色的;②溶液的蓝色逐渐变浅直至消失.①溶液的蓝色不是水分子、硫酸根离子引起的;②硫酸铜溶液的颜色是由铜离子引起的.
通过观察硫酸钾溶液可以确定水分子、硫酸根离子能否使溶液显蓝色;
硫酸铜能和氢氧化钠反应生成蓝色沉淀氢氧化铜和硫酸钠,当硫酸铜完全反应时,溶液由蓝色变成无色,生成的硫酸钠溶液是无色的,可以说明硫酸根离子是无色的,同时说明溶液的蓝色的是由Cu2+引起的.
验证如下:
①步骤:取适量硫酸钾溶液于试管中,观察溶液的颜色;现象:溶液是无色的;结论:溶液的蓝色不是水分子、硫酸根离子引起的;
②步骤:向硫酸铜溶液中滴加氢氧化钠溶液;现象:溶液的蓝色逐渐变浅直至消失;结论:硫酸铜溶液的颜色是由铜离子引起的.
故填:①取适量硫酸钾溶液于试管中,观察溶液的颜色;②向硫酸铜溶液中滴加氢氧化钠溶液.①溶液是无色的;②溶液的蓝色逐渐变浅直至消失.①溶液的蓝色不是水分子、硫酸根离子引起的;②硫酸铜溶液的颜色是由铜离子引起的.

练习册系列答案
相关题目

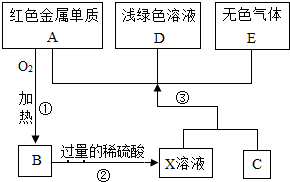 A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,X溶液显蓝色,r如图是它们之间的相互转化关系.(已知氧化铜能跟稀硫酸反应生成硫酸铜和水)请回答:
A、B、C、D、E为初中化学常见的物质,其中A、C为金属单质,E为非金属单质,X溶液显蓝色,r如图是它们之间的相互转化关系.(已知氧化铜能跟稀硫酸反应生成硫酸铜和水)请回答: