题目内容
【题目】向79.8克MgCl2和HCl的混合溶液中,逐滴加入10%的氢氧化钠溶液,反应情况如下图所示.
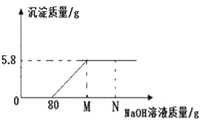
(1)当加入10%的氢氧化钠溶液的质量为N时,溶液中的溶质是_______(填化学式)
(2)试计算,当加入10%的氢氧化钠溶液的质量为M时溶液中溶质的质量分数。(写出计算过程)
【答案】(1)NaCl和NaOH
(2)10%
【解析】(1)当加入10%的氢氧化钠溶液的质量为N时,氢氧化钠过量,溶液中的溶质是NaCl和NaOH。(2)解∶设氢氧化钠溶液与盐酸反应生成氯化钠质量为xg,与氯化镁反应生成氯化钠质量为yg,参加反应的氢氧化钠质量为zg.
NaOH+HCl=NaCl+H2O 2NaOH+MgCl2=2 NaCl+Mg﹙OH﹚2 ↓
40 58.5 80 117 58
10%×80g x z y 5.8g
![]() =
= ![]() ,x=11.7g.
,x=11.7g. ![]() =
=![]() ,y=11.7g.
,y=11.7g. ![]() =
=![]() ,z=8g.
,z=8g.
当加入10%的氢氧化钠溶液的质量为M时溶液中溶质的质量分数∶溶质质量∶11.7g+11.7g=23.4g.溶液质量∶79.8g+80g+80g-5.8g=234g
当加入10%的氢氧化钠溶液的质量为M时溶液中溶质的质量分数∶![]() ×100%=10%.
×100%=10%.
点睛∶本题主要考查质量守恒定律的应用以及根据化学方程式进行计算。

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
