题目内容
【题目】用如图微型仪器来完成制取并检验二氧化碳的实验只消耗了0.55g10%的盐酸(密度为1.1g/ml)。通过计算回答:
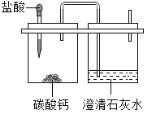
(1)产生二氧化碳的质量是多少?
(2)如果用锥形瓶来完成这个实验约需10%的盐酸5ml,
这是微型实验所用药品量的多少倍?
【答案】(1)0.03g (2)10
【解析】
试题分析:根据化学反应方程式:CaCO3+2HCl==CaCl2+H2O+CO2↑中HCl与CO2的质量关系,即可求出产生的二氧化碳质量
解:设产生二氧化碳的质量为χ
0.55g10%的盐酸中含有溶质的质量为:0.55g×10% =0.055g
CaCO3+2HCl==CaCl2+H2O+CO2↑
73 44
0.055g χ
73/44 = 0.55g×10%/χ
χ = 0.03g
(2)0.55g10%盐酸的体积为:0.55g÷1.1g/ml =0.5ml
是微型实验所用药品量的倍数= 5ml/0.5ml =10

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】(13分)钠的化合物在日常生活中应用广泛.
(1)碳酸氢钠是发酵粉的成分之一,其俗称是 .
(2)氯化钠是重要的调味品,通过以下化学反应均能生成NaCl.
反应一:钠在氯气中燃烧.反应的化学方程式为 .
反应二:NaOH溶液与稀盐酸反应.关于该反应,下列说法正确的是
A.该反应是中和反应
B.将一定量的稀盐酸逐滴滴入NaOH溶液中,pH不断减小,说明两者发生了反应
C.将一定量的稀盐酸滴入滴有酚酞的NaOH溶液中,溶液仍为红色,说明两者不反应
D.将一定量的稀盐酸与NaOH溶液混合后溶液的pH=7,说明两者发生了反应
E.将NaOH固体放入稀盐酸中,放出热量,说明两者发生了反应
反应三:用Na2CO3溶液和稀盐酸混合.反应的化学方程式为: .
充分反应后的溶液中一定有NaCl,可能有Na2CO3或盐酸.
①为确定反应后溶液中的溶质,同学们进行了如下实验:
步骤I、确定溶液中是否含有盐酸:
甲同学选用了酸碱指示剂中的 试液;
乙同学选用了镁粉,通过实验观察到 ,确定溶液中一定没有盐酸.
步骤II、通过实验确定溶液中含有Na2CO3
②欲从反应后溶液中得到纯净的NaCl,丙同学设计了如下实验方案:
方案 | 加入试剂 | 分离方法 | 方案评价 |
一 | 适量Ba(OH)2溶液 | 过滤、蒸发结晶 | 不可行,理由是: |
二 | 适量的 | 可行 |
(3)(4分)过氧化钠(Na2O2)是供氧设备中常用的供氧剂.韩国“岁月号”沉船事故发生后,
几百名潜水员携带水下供氧设备参与了打捞工作.过氧化钠与水的反应为:2Na2O2+2H2O═4NaOH+O2↑.现将15.6g过氧化钠加入盛有147.6g水(过量)的烧杯中充分反应,直至固体完全消失,不再有气泡产生.
请计算:①反应生成的氧气质量;②反应后所得溶液中溶质的质量分数.(写出计算过程)