题目内容
【题目】某化学小组的同学利用CuSO4、FeSO4的混合溶液进行如下探究实验.
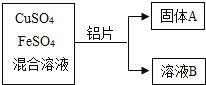
(1)写出铝和硫酸铜溶液反应的化学方程式_____.
(2)向固体A上滴加稀盐酸,若有气泡产生,则A中一定含有的固体有哪些_____?若无气泡产,则溶液B中一定含有的溶质有哪些_____?
【答案】3CuSO4+2Al=3Cu+Al2(SO4)3; 铜和铁, 硫酸亚铁和硫酸铝;
【解析】
(1)根据铝和硫酸铜反应生成硫酸铝和铜进行分析,化学方程式为:3CuSO4+2Al=3Cu+Al2(SO4)3;
(2)根据铝的金属活动性比铁、铜强,铝会先置换出溶液中的铜,然后再置换出铁,铁的活动性排在氢之前,铜不会与酸反应生成氢气,向固体A中滴加稀盐酸,有气泡产生,说明固体中一定含有铁、铜,可能含有铝;无气泡产生,说明固体中一定不含铁和铝,所以溶液中一定含有硫酸铝和硫酸亚铁。

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】化学源于生活,服务于生活。研究“水”可从多角度展开。
(1)水的电解
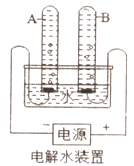
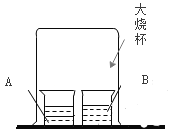
①宏观现象:按如图所示装置,通电一段时间后,试管A、B中产生气体的体积比约为_____,常在水中加入氢氧化钠的作用是_____。
②微观该反应中发生分解的微粒名称是_____,没有发生变化的粒子符号是_____。
(2)水的性质
将黄豆大小的金属钾放入盛有水的烧杯中,生成氢气和氢氧化钾。写出该反应的化学方程式_____。
(3)下列与水有关的实验中,实验和对应的解析都正确的是_____。
实验操作 | 解析 | |
A | 将燃烧的硫放盛有入留有少量水的氧气的集气瓶中 | 水可以吸收生成的二氧化硫,防止有毒气体外逸污染空气 |
B | 粗盐的提纯用到水溶解粗盐再过滤 | 根据物质在水中的溶解性的不同,把混合物进行分离除杂 |
C | 用水灭火 | 水能吸收热量,从而降低环境温度到可燃物着火点以下 |
D | 用氯化钠溶液进行导电性试验,观察小灯泡是否变亮 | 小灯泡变亮,说明氯化钠溶液中存在自由移动的离子 |