题目内容
【题目】(13分)某小组在学习“二氧化碳制取的研究”课题时,探究了二氧化碳气体的收集方法。
【查阅资料】
通常状况下,1 体积水约能溶解1 体积二氧化碳,所得溶液PH 约为5.6。
【提出问题】
二氧化碳能不能用排水法收集?
【实验设计与操作】
实验一、在通常状况下,测定二氧化碳溶液水所得溶液调查PH,判断二氧化碳在水中溶解度的体积。

(1)甲装置中反应的化学方程式是 。
(2)实验时,需先将甲装置中的空气排尽。其操作是:开启弹簧夹 、关闭弹簧夹 ,打开活塞,滴加稀盐酸至空气排尽。检验空气已排尽的方法是 .
(3)关闭K1,打开K2,K3。待丙装置中收集半瓶气体时,关闭活塞K2 和K3,充分振荡丙装置。然后用pH 计测得如下数据:
物质 | 丁装置中溶液 | 丙装置中溶液 |
pH | 6.50 | 5.60 |
分析可知,在丙和丁装置中所溶解二氧化碳的体积 (填“大于”“小于”“等于”)丙和丁装置中溶液的总体积。
(4)实验中,乙装置的作用是 。若没有乙装置,则测出的溶液pH 会 。
实验二:在通常状况下分别测定排空气法和排水法收集的气体中氧气的体积分数,从而得到二氧化碳的体积分数。
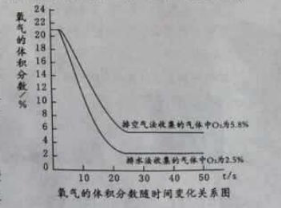
(5)用氧气测量仪测得收集的气体中氧气体积分数随时间的变化关系如图(起始时氧气的体积分数都以21%计),则最终两种方法收集的气体中二氧化碳体积分数较大的是 (填“排空气”或“排水”)法,两种方法收集的气体中二氧化碳体积分数的差值是 。
【结论与反思】
(6)由实验一、二分析,你认为二氧化碳 (填“能”或“不能”)用排水法收集,能减少二氧化碳在水中溶解度的措施是 。(写一条即可)
【答案】(1)CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O
(2)K1;K2、K3;将燃着的木条放在K1的导管口处,如果木条熄灭说明空气已经排尽
(3)小于(4)吸收二氧化碳中的氯化氢气体;偏小(5)排水法;15.7%(6)能;升温
【解析】
试题分析:甲装置中反应的化学方程式是CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O;实验时,需先将甲装置中的空气排尽。其操作是:开启弹簧夹K1,关闭弹簧夹K2、K3;让空气从K1出去;检验空气已排尽的方法是将燃着的木条放在K1的导管口处,如果木条熄灭说明空气已经排尽;分析可知,在丙和丁装置中所溶解二氧化碳的体积小于丙和丁装置中溶液的总体积。实验中,乙装置的作用是吸收二氧化碳中的氯化氢气体;若没有乙装置,则测出的溶液pH 会偏小,因为其中混有的氯化氢气体具有酸性;用氧气测量仪测得收集的气体中氧气体积分数随时间的变化关系如图(起始时氧气的体积分数都以21%计),则最终两种方法收集的气体中二氧化碳体积分数较大的是排水法,因为排水法收集到的氧气的体积分数明显小于排空气法收集到的,两种方法收集的气体中二氧化碳体积分数的差值是15.7%;由实验一、二分析,你认为二氧化碳能够用排水法收集,能减少二氧化碳在水中溶解度的措施是升温或加酸或者事先制成二氧化碳的饱和溶液。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案