题目内容
【题目】现有25 g石灰石样品,请按下面要求计算:
(1)25 g样品与足量的稀盐酸反应放出8.8 gCO2(杂质不溶于酸,且不与酸反应),请计算该样品的纯度(CaCO3的质量分数)是多少_______?
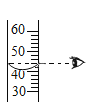
(2)若将25 g样品平均分成两份,分别加工成块状和粉末状,将两份样品分别放入锥形瓶中,同时加入相同体积,相同浓度的足量稀盐酸充分反应,请在图像上画出块状样品和粉末状药品与稀盐酸反应放出CO2的曲线示意图______。
(3)若将一定质量的该石灰石样品高温煅烧,有关物质质量随反应时间的变化如表所示:
时间/min | t1 | t2 | t3 | t4 | t5 |
CO2质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
剩余固体质量/g | 22.8 | 20.6 | m | 16.2 | 16.2 |
则m=_______,t3时剩余固体中除杂质外含有的物质是_____(填化学式)。
【答案】80% 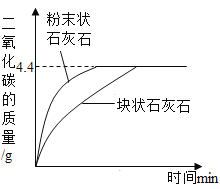 18.4 CaCO3和CaO
18.4 CaCO3和CaO
【解析】
石灰石主要成分是碳酸钙,能与稀盐酸反应生成二氧化碳、氯化钙、水。根据题意8.8 gCO2是碳酸钙与稀盐酸反应生成的。
(1)设样品中碳酸钙的质量是x,
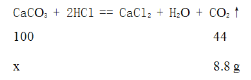
![]() =
=![]() ,解得x=20g,
,解得x=20g,
样品的纯度(CaCO3的质量分数)是:![]() ×100%=80%
×100%=80%
(2)反应物之间接触面积越大,反应速度越快,等质量的碳酸钙与足量的稀盐酸反应,生成二氧化碳的质量相等,所以块状的反应所用时间长,粉末块状的反应所用时间短。
(3)根据质量守恒定律可得,m+6.6 g=2.2 g+22.8 g,m=18.4 g;而t4时固体质量不再减少,且为16.2 g,而t3时固体为18.4 g,说明此时尚有碳酸钙没有完全分解,所以t3时剩余固体中除杂质外含有的物质是氧化钙和碳酸钙,对应的化学式为:CaCO3和CaO。

 名校课堂系列答案
名校课堂系列答案【题目】小华同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
(提出问题)金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
(猜想与假设)a.可能与盐酸的浓度有关;b.可能与反应时的温度有关;c.你的猜想是________。
实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
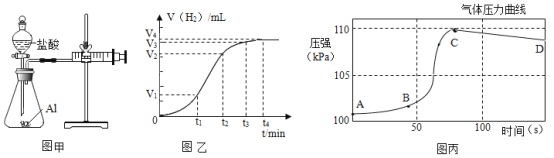
(设计并实验)小明利用图甲所示装置,用不同浓度的盐酸和相同形状的铝片进行如下实验。
(交流讨论)(1)请写出铝与酸反应的化学方程式:____________。
(2)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是__________。
(分析数据、得出结论)(3)实验中记录的数据可能是:__________;对比实验②③可知_________对金属与酸反应的速率的影响
(4)实验表明,四次实验时反应的速率由快到慢依次为④、②、①、③.根据记录的数据分析,如果盐酸浓度为10%,温度为25℃,则所记录数据应该介于_____________两次实验所记录的数据之间。
(拓展延伸)(5)小明进行铝与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳铝与稀盐酸反应速率的变化规律:___________。
(6)研究小组同学对铝和稀盐酸的反应进行再探究。将橡皮塞连接气体压力传感器,烧瓶中放入图片和稀盐酸,塞紧瓶塞并打开仪器,一段时间后,得到如丙图所示的气体压强与时间的关系曲线图。CD段气体压力逐渐下降的原因是:___________。