题目内容
【题目】硫酸铜是一种应用极其广泛的化工原
料,易溶于水而不易溶于酒精;铜离子完全沉淀
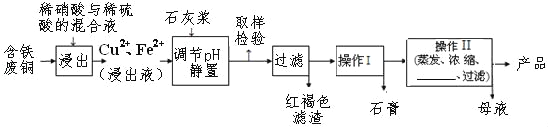
的pH是5左右,铁离子完全沉淀的pH是2左右.以下是某工厂用含铁废铜为原料生产胆矾(CuSO45H2O)和副产物石膏(CaSO42H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)如表.
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是_____;
(2)铜和稀硝酸反应的化学方程式3Cu+8HNO3=_____+2NO↑+4H2O;
(3)石灰浆调pH大约要调节到_____
A.2 B.5 C.7 D.10
(4)操作I最后温度应该控制在_____℃左右;
(5)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、冷却结晶、_____、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是_____.
【答案】氢氧化铁 ;3Cu(NO3)2A100过滤 、硫酸铜易溶于水而不易溶于酒精 .
【解析】
(1)氢氧化铁是红褐色沉淀;(2)化学反应遵循质量守恒定律,即反应前后元素种类不变,原子种类、总个数和质量都不变;(3)根据要求石灰浆调pH大约需要的范围;(4)根据物质的溶解度可以判断相关方面的问题;(5)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是硫酸铜易溶于水而不易溶于酒精。
(1)氢氧化铁是红褐色沉淀,因此红褐色滤渣的主要成分是氢氧化铁;
(2)由质量守恒定律可知,反应前后氢原子都是8个,反应前铜原子是3个,反应后应该是3个,包含在未知物质中,反应前氮原子是8个,其中6个包含在未知物质中,反应前氧原子是24个,反应后应该是24个,其中18个包含在未知物质中,所以化学式为:Cu(NO3)2,因此反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)石灰浆调pH大约要调节到2,因为这时铁离子完全沉淀,铜离子没有沉淀;
(4)操作I最后温度应该控制在100℃左右,因为这时石膏的溶解度最小,胆矾的溶解度最大,有利于石膏沉淀析出;
(5)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是硫酸铜易溶于水而不易溶于酒精。

【题目】几种物质的溶解度如下表所示,根据表中信息回答下列问题:
温度/℃ 溶解度/g | 0 | 20 | 40 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
NaCl | 35.7 | 36 | 36.6 | 37.3 | 38.4 | 39.8 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 245 |
(1)溶解度随温度升高而减小的是_______ 。(填化学式)
(2)硝酸钾固体中混有少量氯化钠固体,欲分离该混合物获得更纯的硝酸钾, 可在较高温度时制成饱溶液,然后_______。
(3)配制 20℃时氯化钠的饱和溶液 68g,需水_______ g。