题目内容
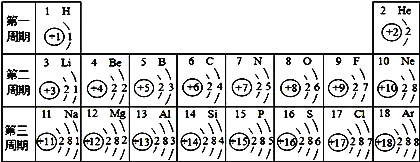
【题目】在点燃条件下,A和B反应生成C和D。反应前后分子种类变化的微观示意图如下所示。请回答下列问题:

(1)1个B分子中共含有____个原子。 (2)A中氮元素的化合价是_____。
(3)上图A、B、C、D四种物质中,属于化合物的是___________________。
(4)根据你对物质、分子、原子、离子的理解,补充完成以下关系图。
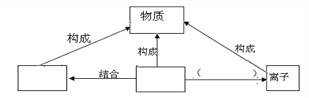
_______________ _____________ __________________
【答案】 2 -3 A、D 分子 原子 得到或失去电子
【解析】用反应前后分子变化的微观示意图可知,该反应的反应物A的分子由1个N原子和3个H原子构成的NH3分子,反应物B的分子由2个O原子构成的O2分子;生成物C的分子由2个N原子构成的N2分子,生成物D的分子由1个O原子和2个H原子构成的H2O分子;则反应的化学方程式为4NH3+3O2点燃2N2+6H2O。A中氢元素显-1价,根据化合物中各元素正负化合价代数和为0可计算A中氮元素的化合价,依据化合物由不同种元素组成,化合物的分子由不同种原子构成,分析各物质的分子构成;根据物质、元素、分子、原子关系分析回答。物质由由分子、原子、离子构成;分子可分成原子,原子可重新组合成分子,原子得失电子形成离子。解:由分析可知该反应的方程式为:4NH3+3O2点燃2N2+6H2O。(1)、B是氧气,因此1个B分子中含有2个氧原子;(2)、A是NH3,其中氢元素显-1价,所以A中氮元素的化合价为0-(+1×3)=-3;(3)、化合物是由不同元素组成的纯净物,所以在反应中氨气和水属于化合物;(4)、分子、原子、离子可直接构成物质;由分子构成的物质,其分子是由原子构成的,原子可重新组合成分子,原子得失电子形成离子。

 阅读快车系列答案
阅读快车系列答案【题目】空气中氧气含量测定的再认识.
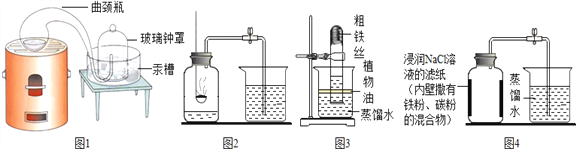
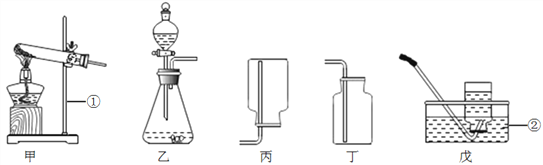
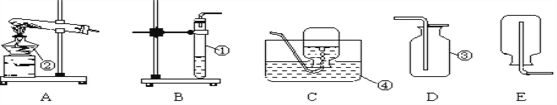
【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1).该实验中选择使用汞的优点有 ____________.
A.实验过程中没有污染
B.在汞槽中起到液封作用
C.生成的化合物加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气集合耗尽
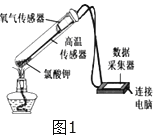
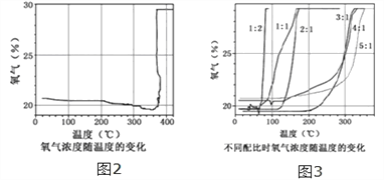
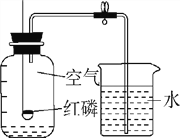
【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的文字表达式________.兴趣小组用该方法测出的氧气含量常常远低于21%.
【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
【进行猜想】(1)装置漏气;(2)_________装置内氧气有剩余;…
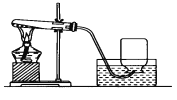
【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3)通过7天测得的数据计算空气中氧气的含量为19.13%.
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定结果更准确的原因:___________________.
【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131mL | 90.0mL | 63.6mL |
请计算出空气中氧气含量________(计算结果保留一位小数)
【结论与反思】通过上述实验探究,选择________(填物质名称)进行实验,可较为快速地完成实验并减小实验误差.
【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿的主要成分为Cu2(OH)2CO3],若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由。 ________(填“能”或“不能”),理由____________。(提示:铜与空气中氧气、水、二氧化碳反应锈蚀时,当参加反应的氧气和二氧化碳的体积相等时,反应才能恰好完成。)