题目内容
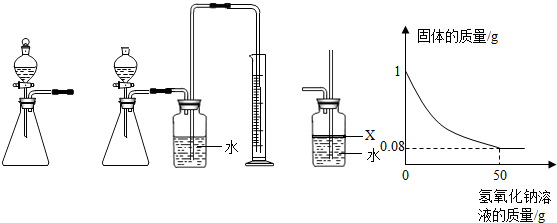
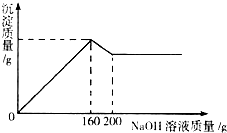 已知氢氧化铝能溶解在过量的氢氧化钠溶液中生成偏铝酸钠(NaAlO2)溶液,有关化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O.现有160.0g某无色溶液,可能含有盐酸、硫酸镁、硝酸钾、硫酸铜、氯化铝、碳酸钠中的一种或数种.取100.0g该溶液于烧杯中,往其中逐滴加入20.0%的NaOH溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图所示.
已知氢氧化铝能溶解在过量的氢氧化钠溶液中生成偏铝酸钠(NaAlO2)溶液,有关化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O.现有160.0g某无色溶液,可能含有盐酸、硫酸镁、硝酸钾、硫酸铜、氯化铝、碳酸钠中的一种或数种.取100.0g该溶液于烧杯中,往其中逐滴加入20.0%的NaOH溶液,产生沉淀的质量与加入NaOH溶液的质量关系如图所示.(1)推断在该溶液中一定存在的物质是
氯化铝、硫酸镁
氯化铝、硫酸镁
,一定不存在的物质是盐酸、硫酸铜、碳酸钠
盐酸、硫酸铜、碳酸钠
.(2)计算原溶液中一种溶质的质量分数.
分析:(1)该溶液为无色,说明一定不含硫酸铜;观察图象,当加入160g氢氧化钠溶液时沉淀质量达到最大,后来逐渐减小,根据题意:氢氧化铝和氢氧化钠可发生反应,说明该溶液中一定含有氯化铝;先生成氢氧化铝,后来氢氧化铝与氢氧化钠发生反应使沉淀减少,沉淀并未全部反应完,说明还含有其他沉淀;
而沉淀从原点开始,说明溶液中一定不含盐酸,因为盐酸可与生成的氢氧化铝发生反应;剩余物质中,硫酸镁可与氢氧化钠反应生成氢氧化镁沉淀,碳酸钠、硝酸钾不与氢氧化钠反应,故一定含有硫酸镁,碳酸钠和硫酸镁会结合生成微溶性的碳酸镁,故二者不能共存,所以溶液中一定不含碳酸钠,可能含有硝酸钾;
(2)由图象可知,当加入160g氢氧化钠溶液时沉淀质量达到最大,说明溶液中物质全部参加反应,后来沉淀减少,说明与氢氧化铝反应的氢氧化钠溶液为200g-160g=40g,据此计算生成氢氧化铝的质量,再由氢氧化钠与氯化铝反应的方程式计算氯化铝的质量.
而沉淀从原点开始,说明溶液中一定不含盐酸,因为盐酸可与生成的氢氧化铝发生反应;剩余物质中,硫酸镁可与氢氧化钠反应生成氢氧化镁沉淀,碳酸钠、硝酸钾不与氢氧化钠反应,故一定含有硫酸镁,碳酸钠和硫酸镁会结合生成微溶性的碳酸镁,故二者不能共存,所以溶液中一定不含碳酸钠,可能含有硝酸钾;
(2)由图象可知,当加入160g氢氧化钠溶液时沉淀质量达到最大,说明溶液中物质全部参加反应,后来沉淀减少,说明与氢氧化铝反应的氢氧化钠溶液为200g-160g=40g,据此计算生成氢氧化铝的质量,再由氢氧化钠与氯化铝反应的方程式计算氯化铝的质量.
解答:解:(1)该溶液为无色,说明一定不含硫酸铜;观察图象,当加入160g氢氧化钠溶液时沉淀质量达到最大,后来逐渐减小,根据题意:氢氧化铝和氢氧化钠可发生反应,说明该溶液中一定含有氯化铝;先生成氢氧化铝,后来氢氧化铝与氢氧化钠发生反应使沉淀减少,沉淀并未全部反应完,说明还含有其他沉淀;而沉淀从原点开始,说明溶液中一定不含盐酸,因为盐酸可与生成的氢氧化铝发生反应;剩余物质中,硫酸镁可与氢氧化钠反应生成氢氧化镁沉淀,碳酸钠、硝酸钾不与氢氧化钠反应,故一定含有硫酸镁,碳酸钠和硫酸镁会结合生成微溶性的碳酸镁,故二者不能共存,所以溶液中一定不含碳酸钠,可能含有硝酸钾;
(2)由图象可知,当加入160g氢氧化钠溶液时沉淀质量达到最大,说明溶液中物质全部参加反应,后来沉淀减少,说明与氢氧化铝反应的氢氧化钠溶液为200g-160g=40g
设生成氢氧化铝的质量为x
Al(OH)3+NaOH=NaAlO2+2H2O
78 40
x 40g×20%
=
x=15.6g
设生成15.6g氢氧化铝需氯化铝的质量为y
AlCl3+3NaOH=Al(OH)3↓+3NaCl
133.5 78
y 7.8g
=
y=26.7g
原溶液中氯化铝的质量分数为:
×100%=26.7%
故答案为:(1)氯化铝、硫酸镁;盐酸、硫酸铜、碳酸钠;
(2)原溶液中氯化铝的质量分数为26.7%.
(2)由图象可知,当加入160g氢氧化钠溶液时沉淀质量达到最大,说明溶液中物质全部参加反应,后来沉淀减少,说明与氢氧化铝反应的氢氧化钠溶液为200g-160g=40g
设生成氢氧化铝的质量为x
Al(OH)3+NaOH=NaAlO2+2H2O
78 40
x 40g×20%
| 78 |
| x |
| 40 |
| 40g×20% |
x=15.6g
设生成15.6g氢氧化铝需氯化铝的质量为y
AlCl3+3NaOH=Al(OH)3↓+3NaCl
133.5 78
y 7.8g
| 133.5 |
| y |
| 78 |
| 15.6g |
y=26.7g
原溶液中氯化铝的质量分数为:
| 26.7g |
| 100.0g |
故答案为:(1)氯化铝、硫酸镁;盐酸、硫酸铜、碳酸钠;
(2)原溶液中氯化铝的质量分数为26.7%.
点评:在解此类题时,首先要分析题中图象各个转折点表示的含义,然后根据题中所给的数据和反应方程式列出关系式进行分析解答,了解物质的性质才能正确分析和推断溶液中所含的物质,本题能很好的考查学生依据所学知识分析解决问题的能力.

练习册系列答案
相关题目