题目内容
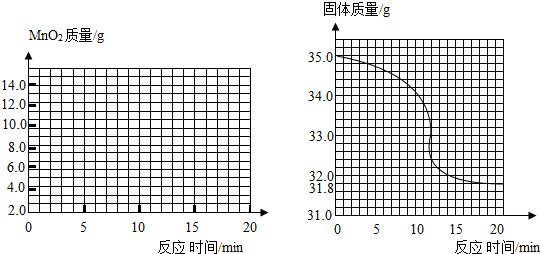
有一黑紫色的固体为KMn04和Mn02的混合物,为测定混合物中KMn04的质量分数,某同学取样35.0g,对固体充分加热,测得固体质量随反应时间变化的曲线如图.(1)生成氧气的总质量为
(2)求该样品中KMn04的质量
(3)该混合物中KMn04的质量分数为
(4)请在左下坐标图中画出Mn02固体的质量与反应时间的关系曲线.
分析:(1)根据质量守恒定律即可求出生成的气体的质量即固体物质总质量的减少;
(2)把生成的氧气的质量代入化学方程式即可计算出参与反应的高锰酸钾的质量和生成的二氧化锰的质量;
(3)根据KMn04质量以及混合物的总质量,即可求得混合物中KMn04的质量分数;
(4)根据样品中高锰酸钾的质量可以求得样品中二氧化锰的质量;再根据反应方程式可以求得反应生成的二氧化锰的质量;据此即可画出Mn02固体的质量与反应时间的关系曲线.
(2)把生成的氧气的质量代入化学方程式即可计算出参与反应的高锰酸钾的质量和生成的二氧化锰的质量;
(3)根据KMn04质量以及混合物的总质量,即可求得混合物中KMn04的质量分数;
(4)根据样品中高锰酸钾的质量可以求得样品中二氧化锰的质量;再根据反应方程式可以求得反应生成的二氧化锰的质量;据此即可画出Mn02固体的质量与反应时间的关系曲线.
解答:解:(1)根据质量守恒定律得知,生成的氧气的质量为:35g-31.8g=3.2g;
故答案为:3.2.
(2)设参与反应的高锰酸钾的质量为x,生成二氧化锰的质量为y;
2KMnO4
K2MnO4+MnO2+O2↑
316 87 32
x y 3.2g
=
,
=
;
解得:x=31.6g,y=8.7g;
故答案为:31.6g.
(3)样品中高锰酸钾的质量分数是
×100%=90.3%
故答案为:90.3%.
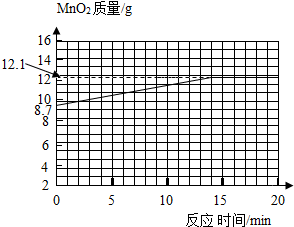
(4)35g样品中KMn04的质量为31.6g,
则样品中MnO2的质量为35g-31.6g=3.4g;
生成的二氧化锰的质量为8.7g;
则MnO2的总质量为:3.4g+8.7g=12.1g;
故二氧化锰的质量从8.7g开始会慢慢的增多,直到第15分钟时高锰酸钾全部反应,此时二氧化锰的质量达到最大值;以后二氧化锰的质量将不再变化.
故答案为:
故答案为:3.2.
(2)设参与反应的高锰酸钾的质量为x,生成二氧化锰的质量为y;
2KMnO4
| ||
316 87 32
x y 3.2g
| 316 |
| x |
| 32 |
| 3.2g |
| 87 |
| y |
| 32 |
| 3.2g |
解得:x=31.6g,y=8.7g;
故答案为:31.6g.
(3)样品中高锰酸钾的质量分数是
| 31.6g |
| 35g |
故答案为:90.3%.
(4)35g样品中KMn04的质量为31.6g,
则样品中MnO2的质量为35g-31.6g=3.4g;
生成的二氧化锰的质量为8.7g;
则MnO2的总质量为:3.4g+8.7g=12.1g;
故二氧化锰的质量从8.7g开始会慢慢的增多,直到第15分钟时高锰酸钾全部反应,此时二氧化锰的质量达到最大值;以后二氧化锰的质量将不再变化.
故答案为:

点评:本题主要考查了根据化学方程式的计算和质量守恒定律的应用;本题难度不大,但很容易出错,在分析题目时一定注意量的关系.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
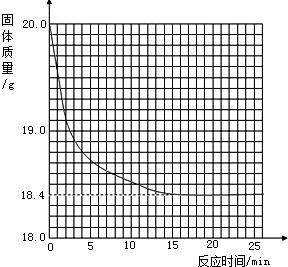 有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样20.0g,对固体充分加热,测得固体质量随反应时间变化的曲线见下图.
有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样20.0g,对固体充分加热,测得固体质量随反应时间变化的曲线见下图.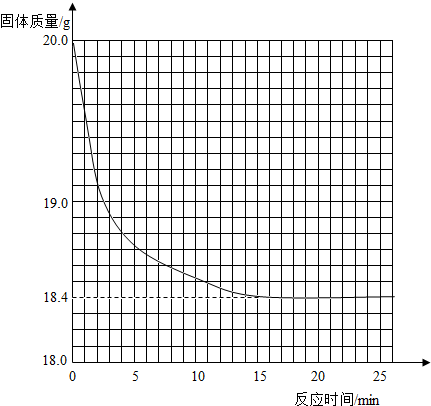

 有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样35.0g,对固体充分加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样35.0g,对固体充分加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):