题目内容
(2007?如东县一模)某班同学在做完“二氧化碳的制取和性质”实验后,废液缸内盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质).为了对废液进行探究,某小组同学进行了如下实验:取废液缸中的澄清溶液20g盛于烧杯中,逐滴加入5.3%的碳酸钠溶液使其完全反应.有关实验数据记录如下表.当碳酸钠溶液滴加至50g(已过量)时,将杯中物质进行过滤后得干燥固体1.0g.其他数据记录如下:| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入Na2CO3溶液/g | 10.0 | 20.0 | 30.0 | 40.0 | 50.0 |
| 杯中物质的总质量/g | 29.78 | 39.56 | 49.56 | 59.56 | 未测 |
(2)20g废液中含氯化氢的质量.

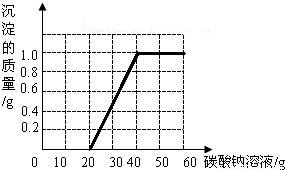
(3)请在右图中画出生成沉淀随加入Na2CO3溶液质量变化的曲线.
(4)当废液中两种物质刚好消耗完毕时,所得溶液中氯化钠的质量分数.
【答案】分析:(1)根据表中实验数据,分析随着碳酸钠溶液的加入烧杯中所余物质质量的变化,当加入碳酸钠溶液后烧杯中剩余物质质量不再减少,则溶液中盐酸完全反应;利用此时变化前后剩余物质质量的差,计算出生成二氧化碳的质量;
(2)由碳酸钠与盐酸反应的化学方程式,由放出二氧化碳的质量计算反应所消耗盐酸的质量;
(3)由表中实验数据,判断所加入碳酸钠溶液与氯化钙开始反应生成沉淀时的质量,此为曲线的起点;由反应化学方程式,由生成沉淀的质量,计算恰好完全反应时,消耗碳酸钠溶液的质量,判断曲线的折点;
(4)反应后溶液为氯化钠溶液,其中氯化钠质量为所加碳酸钠与盐酸及氯化钠反应所生成氯化钠的质量和,反应后所得溶液的质量可根据质量守恒定律求得,最后利用溶液的溶质质量分数计算所得溶液中氯化钠的质量分数.
解答:解:(1)由实验数据,第1次、第2次加入碳酸钠溶液时,烧杯内剩余物质总质量都有所减小,而第3次加入碳酸钠溶液,烧杯中所剩余物质质量不再减少,说明前两次所加入的碳酸钠溶液已经把盐酸完全反应;此时反应放出二氧化碳的质量=20g+20g-39.56g=0.44g;
(2)设20g废液中含氯化氢的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
x 0.44g
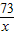 =
= x=0.73g
x=0.73g
(3)当加入20g碳酸钠溶液时,混合溶液中的盐酸完全反应,此时,所加入的碳酸钠溶液开始与氯化钙反应,生成碳酸钙沉淀;此时为曲线的起点;
设恰好完全反应时,消耗碳酸钠溶液的质量为y
Na2CO3+CaCl2═2NaCl+CaCO3↓
106 100
y×5.3% 1g
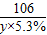 =
=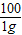 y=20g,即加入碳酸钠溶液的质量(20+20)g=40g时,恰好完全反应;此时为曲线的折点,以后沉淀质量不再改变;
y=20g,即加入碳酸钠溶液的质量(20+20)g=40g时,恰好完全反应;此时为曲线的折点,以后沉淀质量不再改变;
(4)设加入40g碳酸钠溶液时,可生成氯化钠的质量为z
Na2CO3~2NaCl
106 117
40g×5.3% z
 =
=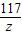 z=2.34g
z=2.34g
所得溶液中氯化钠的质量分数=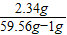 ×100%=4.0%
×100%=4.0%
故答案为:
(1)盐酸完全反应时生成的二氧化碳的质量为0.44g;
(2)20g废液中含氯化氢的质量为0.73g;
(3)
(4)所得溶液中氯化钠的质量分数为4.0%.
(其他解法合理正确均给分)
点评:绘制随加入碳酸钠溶液质量增加而生成沉淀的质量曲线时,曲线的起点即混合溶液中盐酸恰好完全反应,曲线的折点即混合溶液中氯化钙恰好完全反应.
(2)由碳酸钠与盐酸反应的化学方程式,由放出二氧化碳的质量计算反应所消耗盐酸的质量;
(3)由表中实验数据,判断所加入碳酸钠溶液与氯化钙开始反应生成沉淀时的质量,此为曲线的起点;由反应化学方程式,由生成沉淀的质量,计算恰好完全反应时,消耗碳酸钠溶液的质量,判断曲线的折点;
(4)反应后溶液为氯化钠溶液,其中氯化钠质量为所加碳酸钠与盐酸及氯化钠反应所生成氯化钠的质量和,反应后所得溶液的质量可根据质量守恒定律求得,最后利用溶液的溶质质量分数计算所得溶液中氯化钠的质量分数.
解答:解:(1)由实验数据,第1次、第2次加入碳酸钠溶液时,烧杯内剩余物质总质量都有所减小,而第3次加入碳酸钠溶液,烧杯中所剩余物质质量不再减少,说明前两次所加入的碳酸钠溶液已经把盐酸完全反应;此时反应放出二氧化碳的质量=20g+20g-39.56g=0.44g;
(2)设20g废液中含氯化氢的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
x 0.44g
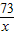 =
= x=0.73g
x=0.73g(3)当加入20g碳酸钠溶液时,混合溶液中的盐酸完全反应,此时,所加入的碳酸钠溶液开始与氯化钙反应,生成碳酸钙沉淀;此时为曲线的起点;
设恰好完全反应时,消耗碳酸钠溶液的质量为y
Na2CO3+CaCl2═2NaCl+CaCO3↓
106 100
y×5.3% 1g
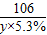 =
=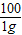 y=20g,即加入碳酸钠溶液的质量(20+20)g=40g时,恰好完全反应;此时为曲线的折点,以后沉淀质量不再改变;
y=20g,即加入碳酸钠溶液的质量(20+20)g=40g时,恰好完全反应;此时为曲线的折点,以后沉淀质量不再改变;(4)设加入40g碳酸钠溶液时,可生成氯化钠的质量为z
Na2CO3~2NaCl
106 117
40g×5.3% z
 =
=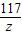 z=2.34g
z=2.34g所得溶液中氯化钠的质量分数=
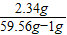 ×100%=4.0%
×100%=4.0%故答案为:
(1)盐酸完全反应时生成的二氧化碳的质量为0.44g;
(2)20g废液中含氯化氢的质量为0.73g;
(3)

(4)所得溶液中氯化钠的质量分数为4.0%.
(其他解法合理正确均给分)
点评:绘制随加入碳酸钠溶液质量增加而生成沉淀的质量曲线时,曲线的起点即混合溶液中盐酸恰好完全反应,曲线的折点即混合溶液中氯化钙恰好完全反应.

练习册系列答案
相关题目
(2007?如东县一模)如图,是两种常用化肥包装上的说明.

(1)图1中化肥名称:方框中合适的名称应为______(填“复合肥料”“过磷酸钙”“磷矿粉”或“草木灰”);图2提示保存碳酸氢铵时应注意______.
(2)小军家小麦生长不茂盛,叶色淡绿.父亲让他去买些化肥回来.到化肥销售点后,
小军根据化肥的品种和价格做出了正确的选择.
你认为小军购买的是______(填写化肥的名称).
(3)化学兴趣小组的同学正在鉴别无标签的五种化肥,它们分别是磷矿粉、碳酸氢铵、氯化钾、尿素、硫酸铵.小红很快从五种化肥中识别出碳酸氢铵,她识别的依据是______.

(1)图1中化肥名称:方框中合适的名称应为______(填“复合肥料”“过磷酸钙”“磷矿粉”或“草木灰”);图2提示保存碳酸氢铵时应注意______.
(2)小军家小麦生长不茂盛,叶色淡绿.父亲让他去买些化肥回来.到化肥销售点后,
小军根据化肥的品种和价格做出了正确的选择.
| 化肥品种 | K2SO4 | KCl | NH4HCO3 | NH4NO3 | CO(NH2)2 |
| 价格(元/kg) | 0.8 | 0.65 | 0.54 | 1.05 | 1.25 |
(3)化学兴趣小组的同学正在鉴别无标签的五种化肥,它们分别是磷矿粉、碳酸氢铵、氯化钾、尿素、硫酸铵.小红很快从五种化肥中识别出碳酸氢铵,她识别的依据是______.

