题目内容
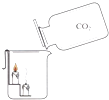
【题目】某同学用氢气还原灼热氧化铜的方法测定水的组成(装置如图所示) 
请回答:
(1)B装置中盛放的液体是 .
(2)C装置中观察到的现象是 .
(3)E装置的作用是 . 如果不连接E装置,得出的实验结论中氢氧元素的质量比(填大于、小于或等于)理论值.
【答案】
(1)浓硫酸
(2)黑色粉末逐渐变成红色
(3)防止空气中的水进入D装置;大于
【解析】解:(1)利用氢气还原氧化铜生成水和铜测定水的组成,则氢气必须是干燥的,否则会造成水的质量偏大,B装置中盛放的液体是液态的干燥剂浓硫酸,以吸收氢气中的水分.(2)氢气还原氧化铜生成铜和水,C装置中观察到的现象是黑色粉末逐渐变成红色.(3)C装置减轻的质量就是生成的水中氧元素的质量,U形管增重即生成的水的质量,故E装置的作用是防止空气中的水进入D装置;如果不连接E装置,则空气中的水进入D装置,会造成水的质量偏大,D中U形管增重即生成的水的质量﹣C装置减轻的质量的质量即为水中氢元素的质量,故得出的实验结论中氢氧元素的质量比大于理论值.
所以答案是:(1)浓硫酸;(2)黑色粉末逐渐变成红色;(3)防止空气中的水进入D装置;大于.
【考点精析】根据题目的已知条件,利用氢气的制取和检验的相关知识可以得到问题的答案,需要掌握氢气的实验室制法原理:Zn + H2SO4 = ZnSO4 +H2↑;Zn + 2HCl = ZnCl2 +H2↑不可用浓盐酸的原因 浓盐酸有强挥发性 ;不可用浓硫酸或硝酸的原因 浓硫酸和硝酸有强氧化性.

练习册系列答案
相关题目