题目内容
6月5日是“世界环境日”,2013年中国主题为“同呼吸共奋斗”。
(1)化石燃料是不可再生能源,包括煤、 和天然气等。
(2)下列不属于空气污染物的是 。
| A.二氧化氮 | B.二氧化硫 | C.PM2.5 | D.氧气 |
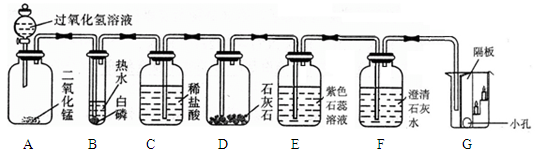
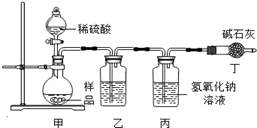
当打开分液漏斗活塞后,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中。E处紫色石蕊溶液变成红色,F处澄清石灰水变浑浊。
①A中发生反应的化学方程式为 。
②B中白磷能够燃烧的原因是 。
③G烧杯中 (填“上层”或“下层”)的蜡烛先熄灭,说明二氧化碳具有的物理性质是 ,具有的化学性质是 。
④E处使紫色石蕊变成红色的物质是 ;写出F处发生变化的化学方程式 。
(1)石油 (2)D (3)①2H2O2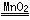 2H2O+O2↑ ②与氧气接触,且温度达到了着火点(或达到了燃烧的条件) ③下层 密度大于空气 不能燃烧也不支持燃烧 ④H2CO3(碳酸) Ca(OH)2+CO2=CaCO3↓+H2O
2H2O+O2↑ ②与氧气接触,且温度达到了着火点(或达到了燃烧的条件) ③下层 密度大于空气 不能燃烧也不支持燃烧 ④H2CO3(碳酸) Ca(OH)2+CO2=CaCO3↓+H2O
解析试题分析:(1)化石燃料是不可再生能源,包括煤、石油、天然气等;(2)氧气不属于空气污染物因为氧气是空气中的一种成分;(3) ①A中发生反应的化学方程式为2H2O2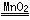 2H2O+O2↑;②B中白磷能够燃烧的原因是:达到了燃烧的条件;③G烧杯中下层的蜡烛先熄灭,说明二氧化碳具有的物理性质是密度比空气的大,具有的化学性质是不能燃烧也不支持燃烧;④E处使紫色石蕊变成红色的物质是生成的碳酸,F处发生变化的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O.
2H2O+O2↑;②B中白磷能够燃烧的原因是:达到了燃烧的条件;③G烧杯中下层的蜡烛先熄灭,说明二氧化碳具有的物理性质是密度比空气的大,具有的化学性质是不能燃烧也不支持燃烧;④E处使紫色石蕊变成红色的物质是生成的碳酸,F处发生变化的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O.
考点:能源的使用造成的环境问题、二氧化碳的性质、燃料燃烧的条件

练习册系列答案
相关题目
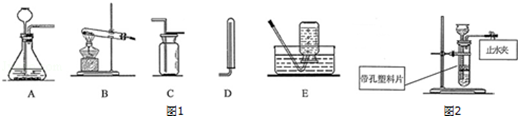
某化学兴趣小组利用如图1装置探究制取气体的原理、方法及性质.结合装置图,回答下列问题:
(1)写出图2中标号仪器的名称:a ,b .
(2)写出实验室用双氧水和二氧化锰制取氧气的化学方程式 ,可选用C装置收集氧气,其原因是 .
(3)实验室通常用如图3所示的洗气装置对氧气进行干燥里面填装的药品可以是 .
| A.浓硫酸 | B.氢氧化钠溶液 |
| C.生石灰 | D.氯化钠固体. |
下列除去杂质的方法中正确的是
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | CaCl2溶液 | 稀盐酸 | 过量碳酸钙、过滤 |
| B | KOH溶液 | KCl | 适量稀盐酸 |
| C | NaCl溶液 | Na2CO3 | 适量硝酸钙溶液、过滤 |
| D | O2 | CO | 通过灼热的氧化铜 |
下列除去杂质的方法中,合理的是( )
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO2 | 水蒸气 | 通入浓硫酸中 |
| B | NaCl溶液 | NaOH溶液 | 加入适量BaCl2溶液,过滤 |
| C | 铁粉 | 铜粉 | 加入足量的稀硫酸,过滤 |
| D | CaO | CaCO3 | 加入适量稀盐酸,过滤 |