题目内容
常用燃烧法测定有机物的组成.现取2.3 g某有机物在足量的氧气中完全燃烧,生成4.4 g CO2和2.7 g H2O.对该物质的组成有下列推断:①一定含C、H元素②一定不含O元素③可能含O元素④一定含O元素⑤分子中C、H的原子个数比为2:5 ⑥分子中C、H、O的元素质量比为12:3:8.其中正确的是( )A.①②⑤
B.①④⑥
C.①③⑤
D.①④⑤
【答案】分析:本题根据有 CO2和 H2O生成,说明有机物一定含有C、H两种元素;氧元素要计算CO2和 H2O中C、H两种元素的质量,若质量和小于2.3 g,则有氧元素,相等则不含氧元素;然后可进一步计算元素质量比和原子个数比.
解答:解:由题意,反应后 CO2和 H2O生成,有机物一定含有C、H两种元素,则①正确;
CO2中C元素的质量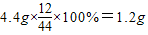
H2O中H元素的质量
1.2g+0.3g=1.5g<2.3g,说明有氧元素,则④正确
C、H、O元素的质量比为:1.2g:0.3g:(2.3-1.5)g=12:3:8,则⑥正确
C、H、O的原子个数比为: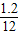 :
: :
: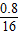 =2:6:1,则⑤不正确
=2:6:1,则⑤不正确
故选B
点评:本题根据元素守恒来确定有机物的组成元素,利用定量计算确定氧元素,是有机物成分确定常用的方法.
解答:解:由题意,反应后 CO2和 H2O生成,有机物一定含有C、H两种元素,则①正确;
CO2中C元素的质量
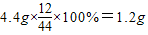
H2O中H元素的质量

1.2g+0.3g=1.5g<2.3g,说明有氧元素,则④正确
C、H、O元素的质量比为:1.2g:0.3g:(2.3-1.5)g=12:3:8,则⑥正确
C、H、O的原子个数比为:
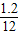 :
: :
: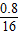 =2:6:1,则⑤不正确
=2:6:1,则⑤不正确故选B
点评:本题根据元素守恒来确定有机物的组成元素,利用定量计算确定氧元素,是有机物成分确定常用的方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常用燃烧法测定有机物的组成.现取3.2g某有机物在足量氧气中充分燃烧,生成4.4gCO2和3.6gH2O,则该有机物中( )(相对原子质量:H-1;C-12;O-16)
| A、一定含C,H两种元素,可能含氧元素 | B、一定含C,H,O三种元素 | C、一定含C,O两种元素,可能含氢元素 | D、只含C,H两种元素,不含氧元素 |