题目内容
微粒模型观察与比较.如下图所示,在钠与氯气的反应中,每个钠原子失去1个电子,成为1个钠离子;每个氯原子得到1个电子,成为1个氯离子;钠离子与氯离子结合形成氯化钠.因为1个电子的质量大约为1个质子或中子质量的 ,故原子的质量几乎都集中在原子核上.
,故原子的质量几乎都集中在原子核上.若用r、m分别表示微粒的半径和质量,以“<”或“>”或“≈”填空.
(1)m(Na)______m(Na+); (2)r(Cl)______r(Cl-);
(3)r(Na)______r(C1); (4)r(Na+)______r(Cl-).

【答案】分析:根据元素周期律:同周期的元素一般满足从左往右半径依次减小,因为半径越小,对电子的吸附能力就越强,外围的电子数就越多;看离子核外电子层数,层数越多离子半径越大,进行解答.
解答:解:(1)1个电子的质量大约为1个质子或中子质量的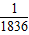 ,故原子的质量几乎都集中在原子核上,所以
,故原子的质量几乎都集中在原子核上,所以
m(Na)≈m(Na+); 故答案为:≈;
(2)因为Cl离子比Cl原子多了1个电子,所以Cl离子的半径大于Cl原子的半径;r(Cl)<r(Cl-);故答案为:<;
(3)根据同周期的元素一般满足从左往右半径依次减小,可知:r(Na)>r(C1); 故答案为:>;
(4)离子半径比较:第一先看离子核外电子层数,层数越多离子半径越大,第二电子层数相同,看核电核数
核电核数越大对外界电子的吸引力越大,离子半径反而越小.
Na+只有两层电子层,Cl-有三层,因此Cl->Na+,可知:r(Na+)<r(Cl-).故答案为:<.
点评:本题考查学生对元素周期律:同周期的元素一般满足从左往右半径依次减小,进行解分析解题的能力.
解答:解:(1)1个电子的质量大约为1个质子或中子质量的
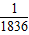 ,故原子的质量几乎都集中在原子核上,所以
,故原子的质量几乎都集中在原子核上,所以m(Na)≈m(Na+); 故答案为:≈;
(2)因为Cl离子比Cl原子多了1个电子,所以Cl离子的半径大于Cl原子的半径;r(Cl)<r(Cl-);故答案为:<;
(3)根据同周期的元素一般满足从左往右半径依次减小,可知:r(Na)>r(C1); 故答案为:>;
(4)离子半径比较:第一先看离子核外电子层数,层数越多离子半径越大,第二电子层数相同,看核电核数
核电核数越大对外界电子的吸引力越大,离子半径反而越小.
Na+只有两层电子层,Cl-有三层,因此Cl->Na+,可知:r(Na+)<r(Cl-).故答案为:<.
点评:本题考查学生对元素周期律:同周期的元素一般满足从左往右半径依次减小,进行解分析解题的能力.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
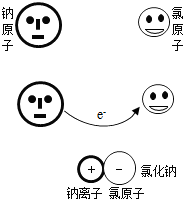 微粒模型观察与比较.如右图所示,在钠与氯气的反应中,每个钠原子失去1个电子,成为1个钠离子;每个氯原子得到1个电子,成为1个氯离子;钠离子与氯离子结合形成氯化钠.因为1个电子的质量大约为1个质子或中子质量的
微粒模型观察与比较.如右图所示,在钠与氯气的反应中,每个钠原子失去1个电子,成为1个钠离子;每个氯原子得到1个电子,成为1个氯离子;钠离子与氯离子结合形成氯化钠.因为1个电子的质量大约为1个质子或中子质量的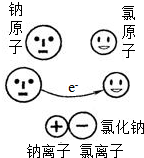 微粒模型观察与比较.如下图所示,在钠与氯气的反应中,每个钠原子失去1个电子,成为1个钠离子;每个氯原子得到1个电子,成为1个氯离子;钠离子与氯离子结合形成氯化钠.因为1个电子的质量大约为1个质子或中子质量的
微粒模型观察与比较.如下图所示,在钠与氯气的反应中,每个钠原子失去1个电子,成为1个钠离子;每个氯原子得到1个电子,成为1个氯离子;钠离子与氯离子结合形成氯化钠.因为1个电子的质量大约为1个质子或中子质量的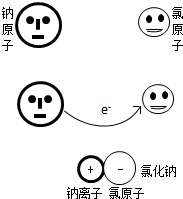
 ,故原子的质量几乎都集中在原子核上。
,故原子的质量几乎都集中在原子核上。 别表示微粒的半径和质量,以“<”或“>”或“≈”填空。
别表示微粒的半径和质量,以“<”或“>”或“≈”填空。
 ▲ r(Cl-);
▲ r(Cl-);