题目内容
【题目】水与人类的生活和生产密切相关,请回答下列问题:
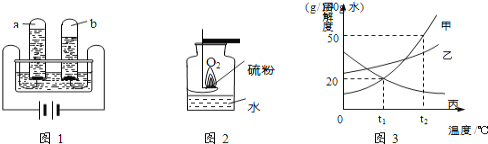
①图1是水通电分解的示意图,在实验过程中,试管a中产生的气体是 (填名称)
②图2实验中生成的SO2被水吸收,且能与水发生反应,写出反应方程式: (提示:CO2和SO2性质相似)
③水是最常见的溶剂,将少量下列物质分别加入水中,不能形成溶液的是 .
A.植物油 B.白糖 C.纯碱 D.硝酸钾
④高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾受热时发生的反应为
4K2FeO4![]() 2R+4K2O+3O2↑
2R+4K2O+3O2↑
则R是 (填化学式).
⑤图3为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线
(Ⅰ)t1℃时,甲物质的溶解度为 ;此温度甲物质的溶解度 乙物质的溶解度(填“>”或“=”或“<”).
(Ⅱ)当等质量甲的饱和溶液和乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的
是 (填序号).
A.都是饱和溶液 B.溶剂质量:甲>乙C.溶液质量:甲<乙D.溶质质量分数:甲>乙.
【答案】①氧气 ②SO2+H2O=H2SO3 ③A ④Fe2O3 ⑤(Ⅰ)20g < (Ⅱ)AC
【解析】
试题分析:①水通电分解与电源正负极相连产生的气体为“正氧负氢”,在实验过程中,试管a对应的是正极,产生的气体是氧气
②根据CO2和SO2性质相似,故SO2与水发生反应的方程式:SO2+H2O=H2SO3
③要形成溶液一定要能溶于水的物质,不能形成溶液的是A植物油,不溶于水
④根据质量守恒定律的微观解释:在化学反应前后,原子的种类、数目都不变,结合化学反应:4K2FeO4△2R+4K2O+3O2↑,可以推出R化学式为Fe2O3
⑤ (Ⅰ) 根据溶解度曲线,t1℃时,甲物质的溶解度为20g;此温度甲物质的溶解度<乙物质的溶解度
(Ⅱ) 根据溶解度曲线,甲乙物质的溶解度都随温度的升高而增大,但甲物质随温度的升高变化的尺逼乙物质要更大,故当等质量甲的饱和溶液和乙的饱和溶液从t2℃降温到t1℃,它们都有晶体析出,但甲析出的更多,故此时A、都是饱和溶液,正确,B、在降温过程中,溶剂质量不变,故溶剂质量:甲<乙,错误,C、由于A析出的晶体质量更多,故溶液质量:甲<乙,正确,D,由于在t1℃时,甲物质的溶解度要小于乙物质的溶解度,故饱和溶质质量分数:甲<乙,错误,故选AC

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案