题目内容
【题目】工业铁红的主要成分是Fe2O3 , 还含有少量的FeO、Fe3O4 . 为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析.
【资料1】草酸晶体(H2C2O43H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O43H2O ![]() CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
(1)下列可用作草酸分解制取气体的装置是(填字母编号). 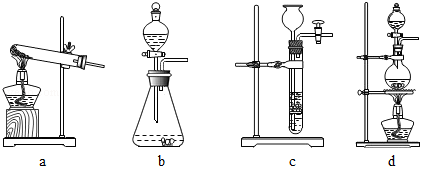
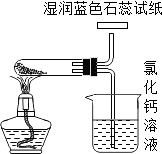
(2)【问题讨论】用图所示装置进行实验: 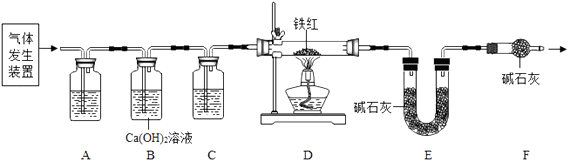
实验前应先 .
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是、(填字母编号). a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)B装置的作用是 .
(5)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是: ①加热前 . ②停止加热后 .
(6)写出D装置中所发生反应的一个化学方程式 .
(7)【数据分析与计算】【资料2】铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.
①D中充分反应后得到Fe粉的质量为m g,则<m< .
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是 .
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会(填“偏小”、“不变”或“偏大”).
反思2:请指出【问题讨论】中实验装置的一个明显缺陷 .
【答案】
(1)d
(2)检查装置气密性
(3)c;a
(4)检验二氧化碳是否被氢氧化钠溶液完全吸收
(5)排出装置中的空气,避免发生安全事故;使反应生成的二氧化碳全部被碱石灰吸收
(6)Fe2O3+3CO ![]() 2Fe+3CO2 , 或FeO+CO
2Fe+3CO2 , 或FeO+CO ![]() Fe+CO2 , 或Fe3O4+4CO
Fe+CO2 , 或Fe3O4+4CO ![]() 3Fe+4CO2
3Fe+4CO2
(7)14.0;15.56;76%;偏小;没有处理尾气
【解析】解:(1)草酸分解需要浓硫酸参加,并且需要加热,应该用d装置作为发生装置. 故填:d.(2)实验前应先检查装置气密性.
故填:检查装置气密性.(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是氢氧化钠溶液、浓硫酸,分别用来吸收二氧化碳和水蒸气.
故填:c;a.(4)B装置的作用是检验二氧化碳是否被氢氧化钠溶液完全吸收.
故填:检验二氧化碳是否被氢氧化钠溶液完全吸收.(5)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:排出装置中的空气,避免发生安全事故,使反应生成的二氧化碳全部被碱石灰吸收.
故填:排出装置中的空气,避免发生安全事故;使反应生成的二氧化碳全部被碱石灰吸收.(6)高温条件下,一氧化碳和氧化铁反应生成铁和二氧化碳,和氧化亚铁反应生成铁和二氧化碳,和四氧化三铁反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO2 , FeO+CO
2Fe+3CO2 , FeO+CO ![]() Fe+CO2 , Fe3O4+4CO
Fe+CO2 , Fe3O4+4CO ![]() 3Fe+4CO2 .
3Fe+4CO2 .
故填:Fe2O3+3CO ![]() 2Fe+3CO2 , 或FeO+CO
2Fe+3CO2 , 或FeO+CO ![]() Fe+CO2 , 或Fe3O4+4CO
Fe+CO2 , 或Fe3O4+4CO ![]() 3Fe+4CO2 . (7)①铁粉质量最大为:10.0g×77.8%=7.78g,最小为:10.0g×70.0%=7.0g,因此D中充分反应后得到Fe粉的质量为mg时,则7.0<m<7.78.
3Fe+4CO2 . (7)①铁粉质量最大为:10.0g×77.8%=7.78g,最小为:10.0g×70.0%=7.0g,因此D中充分反应后得到Fe粉的质量为mg时,则7.0<m<7.78.
故填:7.0;7.78.②实验前后称得E装置增重6.6g,说明反应生成了6.6g二氧化碳,6.6g二氧化碳最大氧元素一半来自于铁红,铁红中的氧元素质量为:6.6g× ![]() ×100%÷2=2.4g,
×100%÷2=2.4g,
则此铁红中铁的质量分数是: ![]() ×100%=76%,
×100%=76%,
故填:76%.
【考点精析】解答此题的关键在于理解一氧化碳还原氧化铁的相关知识,掌握原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.

 阅读快车系列答案
阅读快车系列答案【题目】下面对灭火原理解释不正确的是( )
灭火实例 | 灭火原理 | |
A | 炒菜油锅着火,用锅盖盖熄 | 隔绝空气或氧气 |
B | 住宅失火,消防员用水灭火 | 降低可燃物的着火点 |
C | 酒精洒在桌上着火,用湿抹布盖灭 | 隔绝空气或氧气 |
D | 扑灭森林火灾,设置隔离带 | 可燃物与燃烧物隔离 |
A.A
B.B
C.C
D.D