题目内容
【题目】有一赤铁矿样品(主要成分为氧化铁),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示:求: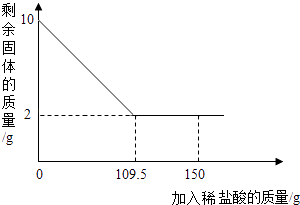
(1)所使用的稀盐酸的溶质质量分数
(2)当稀盐酸和赤铁矿恰好完全反应时,所得溶液的质量是:,赤铁矿总氧化铁的质量分数是:.
(3)问题讨论,小亮也取用10克赤铁矿样品在试管中,通入一氧化碳一段时间后加热,最后试管内残留固体质量是8.2g,小亮比小组所测得的结果(氧化铁的质量分数)比小明的:(填偏大、偏小、无影响),原因可能是:.(写一种即可)
【答案】
(1)
解:氧化铁会与盐酸反应,杂质不溶于水和酸,所以参加反应的氧化铁的质量为:10g﹣2g=8g,氧化铁的质量分数为: ![]() ×100%=80%;
×100%=80%;
设参加反应的盐酸的质量为x
Fe2O3+ | 6HCl=2FeCl3+3H2O |
160 | 219 |
8g | X |
![]() =
= ![]()
x=10.95g
所以所使用的稀盐酸的溶质质量分数为: ![]() ×100%=10%
×100%=10%
(2)
解:当稀盐酸和赤铁矿恰好完全反应时,所得溶液的质量是:109.5g+8g=117.5g
(3)偏小
【解析】解: (3)固体减少
Fe2O3+ | 6HCl=2FeCl3+ | 3H2O |
160 | 219 | 48 |
Y | 1.8g |
![]() =
= ![]()
y=6g![]() ×100%=60%,试管内残留固体质量包含了杂质的质量.
×100%=60%,试管内残留固体质量包含了杂质的质量.
所以答案是:(1)10%;(2)117.5g,80%;(3)偏小,试管内残留固体质量包含了杂质的质量.
【考点精析】掌握根据化学反应方程式的计算是解答本题的根本,需要知道各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目