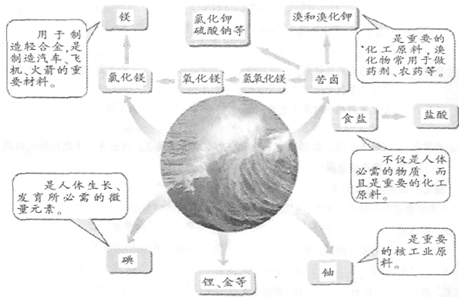
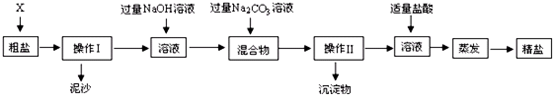
题目内容
下图是NaCl、MgSO4的溶解度曲线。下列说法正确的是
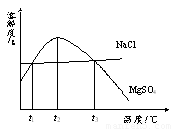
A.NaCl的溶解度随温度的升高变化较大
B.只要温度不同,MgSO4的溶解度一定不同
C.MgSO4饱和溶液的浓度随温度的升高而增大
D.t1 ℃时,两种物质饱和溶液的溶质质量分数相等
【答案】
D
【解析】A、由溶解度曲线图可以看出,NaCl的溶解度随着温度的升高而增大,但变化不大,故错误
B、MgSO4的溶解度有相同的时候,故错误
C、在t2℃~t3℃时,硫酸镁的溶解度先随温度的升高而减小,所以故错误.MgSO4饱和溶液的浓度随温度的升高而减小,故错误
D t1 ℃时,两种物质的溶解度相同,所以两种物质饱和溶液的溶质质量分数相等,故正确
故选D

练习册系列答案
相关题目