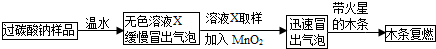题目内容
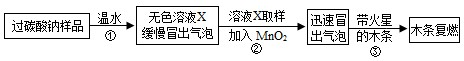
小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.
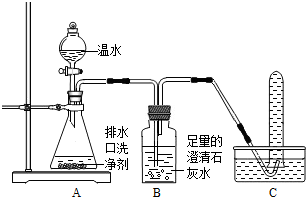
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验.

实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺.由此同学们得出结论:生成的两种气体分别是
【探究二】
(1)实验过程:教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究:

(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是
(4)查找资料:资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;氯化钙溶液与碳酸钠溶液混合后发生生成白色沉淀;氯化钙和氢氧化钠不反应.
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同.
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验.请将下列实验方案填写完整.
有关反应的方程式为
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验.

实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺.由此同学们得出结论:生成的两种气体分别是
O2、CO2
O2、CO2
(填化学式).B中有关反应的化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
.【探究二】
(1)实验过程:教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究:

(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设:根据以上实验现象,X溶液中一定存在的溶质是
H2O2
H2O2
(写化学式);还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种.(4)查找资料:资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;氯化钙溶液与碳酸钠溶液混合后发生生成白色沉淀;氯化钙和氢氧化钠不反应.
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同.
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验.请将下列实验方案填写完整.
| 实验操作 | 主要实验现象 | 结论 |
| ① 取溶液X适量于试管中,加入过量CaCl2溶液 取溶液X适量于试管中,加入过量CaCl2溶液 取①中反应后上层清液适量,加入适量稀盐酸 取①中反应后上层清液适量,加入适量稀盐酸 取①中反应后上层清液适量,加入酚酞试液 取①中反应后上层清液适量,加入酚酞试液 |
出现白色沉淀 出现白色沉淀 无气泡 无气泡 不变色 不变色 |
证明溶液中只有Na2CO3 |
NaHCO3+NaOH=Na2CO3+H2O
NaHCO3+NaOH=Na2CO3+H2O
.分析:【探究一】根据氧气的助燃性及二氧化碳能使澄清的石灰水变浑浊分析判断,并据反应原理书写方程式;
【探究二】(3)因为无色溶液X中加入二氧化锰有氧气生成,因此无色溶液X中含有的一种溶质是过氧化氢;
(5)①根据氯化钙与碳酸氢钠不反应,可取上述无色液体X少量于试管中,加入足量的氯化钙溶液,产生白色沉淀,因此一定有碳酸钠;取步骤①所得上层清液少量,滴加盐酸,没有气泡产生,说明没有碳酸氢钠;③氯化钙、氯化钠溶液呈中性,所以取步骤①所得上层清液少量,加入酚酞试液,若不变色,说明没有氢氧化钠;根据NaHCO3溶液能与石灰水反应生成白色沉淀,推测NaHCO3溶液与氢氧化钠反应方程式.
【探究二】(3)因为无色溶液X中加入二氧化锰有氧气生成,因此无色溶液X中含有的一种溶质是过氧化氢;
(5)①根据氯化钙与碳酸氢钠不反应,可取上述无色液体X少量于试管中,加入足量的氯化钙溶液,产生白色沉淀,因此一定有碳酸钠;取步骤①所得上层清液少量,滴加盐酸,没有气泡产生,说明没有碳酸氢钠;③氯化钙、氯化钠溶液呈中性,所以取步骤①所得上层清液少量,加入酚酞试液,若不变色,说明没有氢氧化钠;根据NaHCO3溶液能与石灰水反应生成白色沉淀,推测NaHCO3溶液与氢氧化钠反应方程式.
解答:解:【探究一】二氧化碳能使澄清石灰水变浑浊,这是二氧化碳的特性;氧气具有助燃性,因此能使燃着的木条燃烧更旺;二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,方程式是:CO2+Ca(OH)2=CaCO3↓+H2O;
【探究二】(3)因为无色溶液X中加入二氧化锰有氧气生成,因此无色溶液X中含有的一种溶质是过氧化氢;
(5)根据资料2可知:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀,碳酸钠也与石灰水反应生成白色沉淀,故不能取石灰水检验碳酸钠的存在;
根据资料1可知:氯化钙溶液与碳酸氢钠溶液混合不发生反应,氯化钙溶液与碳酸钠溶液反应生成沉淀,所以要证明溶液中有碳酸钠,可取上述无色液体X少量于试管中,至不再冒气泡为止,加入过量的氯化钙溶液,若产生白色沉淀,则一定有碳酸钠,加入过量的氯化钙溶液是防止碳酸钠有剩余,对碳酸氢钠、氢氧化钠的检验造成干扰;因为①中加入的是过量的氯化钙溶液,所以碳酸钠完全反应,要证明是否含有碳酸氢钠,可取步骤①所得上层清液少量,滴加盐酸,若没有气泡产生,则没有碳酸氢钠;③因为碳酸钠已完全反应,且氯化钙、氯化钠溶液呈中性,所以可取步骤①所得上层清液少量,加入酚酞试液,若不变色,则说明没有氢氧化钠;
NaHCO3溶液能与石灰水反应生成白色沉淀,依据反应前后元素种类不变,说明生成的沉淀是碳酸钙,同时生成水;据此推测NaHCO3溶液与氢氧化钠反应生成碳酸钠和水,方程式是:NaHCO3+NaOH=Na2CO3+H2O;
故答案为:[探究一]O2、CO2; CO2+Ca(OH)2=CaCO3↓+H2O;
[探究二](3)H2O2;
(5)
NaHCO3+NaOH=Na2CO3+H2O.
【探究二】(3)因为无色溶液X中加入二氧化锰有氧气生成,因此无色溶液X中含有的一种溶质是过氧化氢;
(5)根据资料2可知:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀,碳酸钠也与石灰水反应生成白色沉淀,故不能取石灰水检验碳酸钠的存在;
根据资料1可知:氯化钙溶液与碳酸氢钠溶液混合不发生反应,氯化钙溶液与碳酸钠溶液反应生成沉淀,所以要证明溶液中有碳酸钠,可取上述无色液体X少量于试管中,至不再冒气泡为止,加入过量的氯化钙溶液,若产生白色沉淀,则一定有碳酸钠,加入过量的氯化钙溶液是防止碳酸钠有剩余,对碳酸氢钠、氢氧化钠的检验造成干扰;因为①中加入的是过量的氯化钙溶液,所以碳酸钠完全反应,要证明是否含有碳酸氢钠,可取步骤①所得上层清液少量,滴加盐酸,若没有气泡产生,则没有碳酸氢钠;③因为碳酸钠已完全反应,且氯化钙、氯化钠溶液呈中性,所以可取步骤①所得上层清液少量,加入酚酞试液,若不变色,则说明没有氢氧化钠;
NaHCO3溶液能与石灰水反应生成白色沉淀,依据反应前后元素种类不变,说明生成的沉淀是碳酸钙,同时生成水;据此推测NaHCO3溶液与氢氧化钠反应生成碳酸钠和水,方程式是:NaHCO3+NaOH=Na2CO3+H2O;
故答案为:[探究一]O2、CO2; CO2+Ca(OH)2=CaCO3↓+H2O;
[探究二](3)H2O2;
(5)
| 实验操作 | 主要实验现象 |
| 取溶液X适量于试管中,加入过量CaCl2溶液 | 出现白色沉淀 |
| 取①中反应后上层清液适量,加入适量稀盐酸 | 无气泡 |
| 取①中反应后上层清液适量,加入酚酞试液 | 不变色 |
点评:本题是对实验方法和过程的探究,考查了学生对于常见气体--氧气、二氧化碳性质的掌握,及分析资料,设计实验,书写方程式的能力,要依据题意细心分析,才能得出正确的答案.

练习册系列答案
相关题目
小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡。为了解其反应过程,他与学习小组的同学进行了如下探究。
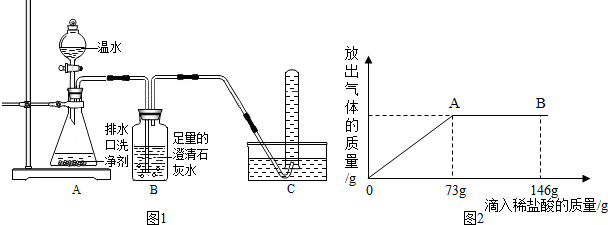
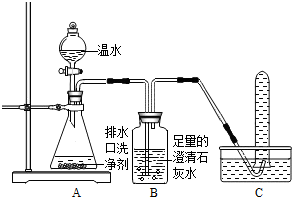
【探究一】小组同学根据所学的化学知识设计并进行了如图所示的实验。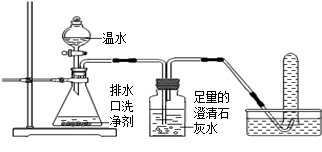
A B C
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气体能使燃着的木条燃烧更旺。由此同学们得出结论:生成的两种气体分别是: (填化学式)。B中有关反应的化学方程式是 。
【探究二】
(1)实验过程:
教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究: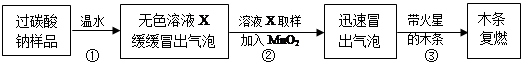
(2)提出问题:无色溶液X中的溶质有哪些物质?
(3)猜想与假设: 根据以上实验现象,X溶液中一定存在的溶质是 ;还可能存在Na2CO3、NaHCO3、NaOH中的一种或几种。
(4)查找资料:
资料1:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;
氯化钙溶液与碳酸钠溶液混合后发生如下反应:Na2CO3 + CaCl2 ═ CaCO3↓ + 2NaCl。
资料2:NaHCO3溶液呈碱性,与石灰水反应生成白色沉淀;碳酸氢钠、碳酸钠与足量的酸反应产物相同。
(5)实验过程:小组同学对溶液X中的溶质进行了如下实验。请将下列实验方案填写完整。
| 实验操作 | 主要实验现象 | 结论 |
| ① | | 证明溶液中有Na2CO3 |
| ② | | 证明溶液中无NaHCO3 |
| ③ | | 证明溶液中无NaOH |
 (2013?潍城区二模)小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.
(2013?潍城区二模)小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.