题目内容
下列图象能正确反映对应的变化关系的是( )
A.  向一定量的稀硫酸中滴加氢氧化钠溶液至过量
向一定量的稀硫酸中滴加氢氧化钠溶液至过量
B.  向一定量的H2SO4和MgSO4混合溶液中滴加氢氧化钡溶液
向一定量的H2SO4和MgSO4混合溶液中滴加氢氧化钡溶液
C. 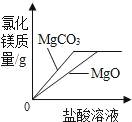 将足量MgCO3和MgO固体分别加入相同质量、相同质量分数的稀盐酸中
将足量MgCO3和MgO固体分别加入相同质量、相同质量分数的稀盐酸中
D. 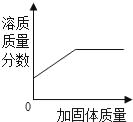 在一定温度下,向不饱和的硝酸钠溶液中不断加入硝酸钠固体,充分搅拌
在一定温度下,向不饱和的硝酸钠溶液中不断加入硝酸钠固体,充分搅拌
某实验小组用石墨做电极进行电解水实验,为增加导电性,改用Ca(OH)2饱和溶液进行电解,实验时除两个电极均有气泡冒出外,溶液中还出现了白色浑浊,该小组对白色浑浊出现的原因进行了如下探究。
(猜想与假设)
①溶液温度升高导致Ca(OH)2析出而出现白色浑浊。
②水减少导致Ca(OH)2析出而出现白色浑浊。
③与石墨电极有关。
(查阅资料)
①Ca(OH)2的溶解度:20℃时为0.16g,100℃时为0.07g。
②在加热条件下铜能与氧气反应生成黑色的氧化铜。铜与稀硫酸不反应;氧化铜能与稀硫酸反应。
(进行实验)
实验 | 实验装置 | 主要实验操作 | 实验现象 |
1 | ﹣﹣ | 取20mLCa(OH)2 饱和溶液加热至沸腾 | 溶液中未出现白色浑浊 |
2 |
| 取Ca(OH)2饱和溶液于烧杯中,加5ml水,通电3min | 烧杯中溶液体积几乎无明显变化,溶液中明显出现白色浑浊 |
3 | 更换石墨电极为铜电极,取Ca(OH)2 饱和溶液于烧杯中,通电3min | 与电源正极相连的铜电极变黑,溶液中未出现白色浑浊 |
(解释与结论)
(1)实验1得出的结论是_____。
(2)实验2通电3min后得到的溶液为_____(填“饱和”或“不饱和”)溶液。
(3)猜想与假设②不成立,依据的现象是_____。
(4)实验3中更换石墨电极为铜电极的目的是_____。
(反思与评价)
(5)为除去实验3中铜电极上的黑色物质,需要的试剂是_____。
(6)通过探究过程,用石墨做电极进行实验时,Ca(OH)2溶液中出现白色浑浊的原因是_____。



 B. 滴加液体
B. 滴加液体
 D. 熄灭酒精灯
D. 熄灭酒精灯