题目内容
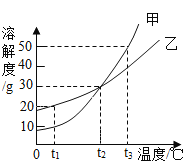
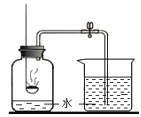
【题目】为测定某敞口放置的氢氧化钠溶液的变质情况。某同学实验并记录如图
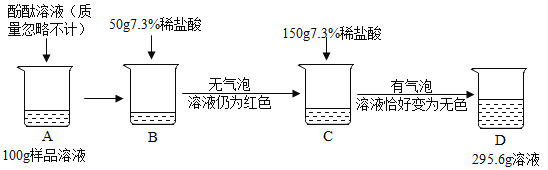
(1)C烧杯溶液中的溶质是________ ;
(2)向D烧杯内加入4.4g水,求所得不饱和溶液中溶质的质量分数?_______(计算结果精确到0.1%)
(3)求原氢氧化钠溶液中变质的氢氧化钠与未变质氢氧化钠的质量比?_____________
【答案】![]() 、
、![]() 、
、![]()
![]() 1:1
1:1
【解析】
(1)氢氧化钠在空气中与二氧化碳反应变质生成碳酸钠,氢氧化钠、碳酸钠与盐酸反应均能生成氯化钠,第一次加入稀盐酸没有二氧化碳气体生成,第二次加入稀盐酸生成二氧化碳的质量为100g+50g+150g-295.6g=4.4g,故样品部分变质,第二次加入稀盐酸后,氢氧化钠、碳酸钠恰好与两次加入的稀盐酸完全反应,第一次加入50g稀盐酸,碳酸钠并未参加反应,设C烧杯溶液中碳酸钠质量为x,由C→D消耗质量分数7.3%稀盐酸的质量为y,则
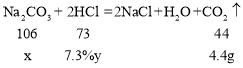
![]()
C→D加入了稀盐酸150g<100g,故C烧杯溶液中的溶质是![]() 、
、![]() 、
、![]() ;
;
(2)D烧杯内溶质只有![]() ,设生成
,设生成![]() 的质量为z,则
的质量为z,则

![]()
所以向D烧杯内加入4.4g水,所得不饱和溶液中溶质的质量分数为:
![]() ;
;
(3)样品中未变质的氢氧化钠消耗质量分数7.3%稀盐酸的质量为50g+150g-100g=100g,设未变质的氢氧化钠的质量为a,则
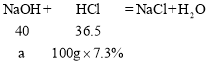
![]() ;
;
设变质的氢氧化钠质量为b,则

![]() ;
;
所以原氢氧化钠溶液中变质的氢氧化钠与未变质的氢氧化钠质量比为8g:8g=1:1。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目